lncRNA,MALAT1通过miR-124-3p/SOX7分子轴促进视网膜血管内皮细胞增殖及迁移和血管生成
陈前波,席晓婷,马 嘉,赵剑峰,王雪维,蔡 斌,程 泉,李俊娴,李 燕
糖尿病视网膜病变(diabetic retinopathy,DR)是糖尿病最常见和严重的并发症之一[1]。DR在糖尿病患者中的发病率超过50%。视网膜血管基底膜增厚、血管内皮细胞异常增殖形成新的血管是DR的主要病理特征[2]。其中,视网膜血管内皮细胞恶性生物学行为加强,引起的微血管功能障碍,或最终导致新生血管形成是危害视网膜功能的主要原因之一[3]。因此,寻找DR患者中与视网膜微血管功能障碍相关的分子并探究其作用机制,有助于发现新的靶标用于诊断或缓解患者微血管功能障碍。近年研究发现,lncRNA MALAT1是在人类多种恶性肿瘤中的一种高表达且具有促癌作用的lncRNA。其表达水平可作为肿瘤发生发展、诊断及预后的标志[4]。lncRNA MALAT1在体内和体外能显著促进血管内皮细胞的成管能力[5]。最近研究表明,lncRNA MALAT1与DR的发展相关[6]。miRNA在转录后水平调控靶基因表达参与或调控疾病的进展已被大量研究证实。并且异常表达的miRNA也被建议作为DR诊断生物标志物[7]。其中,miR-124-3p在DR患者血浆中的表达水平显著降低[8-9]。并且,有研究表明,体外视网膜血管内皮细胞血管生成过程中miR-124-3p的表达显著下调[10]。SOX7(Sex-determining region Y-box 7)在调控心血管系统的发育、内皮细胞向造血细胞转化、动静脉分化等进程中发挥重要作用[11-12]。研究表明,SOX7参与促进和维持视网膜血管系统形成[13]。Starbase网站预测结果表明,SOX7是miR-124-3p的一个靶基因。为此,本研究将探讨lncRNA MALAT1通过miR-124-3p/SOX7分子轴调控视网膜血管内皮细胞增殖、迁移及血管形成的分子机制。深化了解DR患者视网膜新生血管的形成,为发展新的分子标记用于诊断或缓解DR患者微血管功能障碍提供理论依据。
1.1材料细胞株与主要试剂:人视网膜微血管内皮细胞hRMECs(货号:BNCC340362)购自北纳生物昆明细胞库。DMEM、胎牛血清、胰酶购自Hyclone;
青霉素、链霉素购自阿拉丁试剂;
Lipofectamine 2000、Trizol和逆转录试剂盒购自Invitrogen;
qPCR定量试剂盒购自Takara;
RIPA裂解液、BCA蛋白定量试剂盒、ECL显色试剂盒、CCK8试剂盒购自碧云天生物技术公司;
Transwell小室购自Corning;
质粒提取试剂盒、双荧光素报告基因试剂盒购自Promega;
钙黄绿素染色试剂盒购自上海生工;
Western blotting一抗(Antibody-SOX7、Antibody-GADPH)和二抗(羊抗兔)购自Abcam;
Matrigel胶购自BD;
MALAT1、miR-124-3p、U6的引物,miR-124-3p mimic/inhibitor/scramble以及敲低和过表达实验中用到的sh-lncRNA MALAT1、SOX7过表达载体由上海生工代为合成或构建。
1.2方法
1.2.1样本采集收集2016-06/2018-12在云南省第一人民医院就诊的糖尿病患者(糖尿病组,30例)、糖尿病视网膜病变患者(糖尿病视网膜病变组,30例)以及健康志愿者(正常组,30例)空腹状态下早晨6∶00~8∶00时间段的静脉血清样本。入选标准参考中华医学会眼底病组通过的DR临床诊疗指南(2014年)[14],糖尿病患者和糖尿病视网膜病变患者:血糖>10.0mmol/L;
正常志愿者对照血清标本:血糖<7.0mmol/L。本研究通过医院伦理委员会批准,所有研究对象均知情同意。
1.2.2细胞培养和分组及转染hRMECs细胞用10%胎牛血清、100μg/mL青霉素、100μg/mL链霉素的DMEM培养基,在37℃、5% CO2条件下培养。检测葡萄糖处理对lncRNA MALAT1表达水平的影响实验中,将hRMECs细胞分为4组培养96h:阴性对照组(NC组),正常对照组(Control组,5mmol/L D-葡萄糖)、葡萄糖组1(15mmol/L D-葡萄糖)、葡萄糖组2(25mmol/L D-葡萄糖)、葡萄糖组3(35mmol/L D-葡萄糖)。机制研究实验进行以下分组:正常对照组(5mmol/L)(Ⅰ组);
葡萄糖组(25mmol/L)(Ⅱ组);
葡萄糖+过表达miR-124-3p组(Ⅲ组);
葡萄糖+过表达lncRNA MALAT1+过表达miR-124-3p组(Ⅳ组);
葡萄糖+过表达miR-124-3p+过表达SOX7组(Ⅴ组);
葡萄糖+敲低lncRNA MALAT1+过表达SOX7组(Ⅵ组)。
选择生长状况良好的对数期细胞进行实验,0.25%的胰酶消化,调整密度为1×105cell/mL,接种到6孔板,每孔加2mL细胞悬液,培养24h,待细胞融合度达到70%左右,采用lipofectamine 2000按上述分组进行转染。将sh-lncRNA MALAT1、miR-124-3p mimics、pcDNA-SOX7等分别转染到hRMECs,并转染相应的阴性对照。所有实验组均设置3个复孔。
1.2.3qRT-PCR检测lncRNAMALAT1和miR-124-3p的表达水平RNA提取试剂盒提取各组细胞的总RNA,DNA酶处理后进行逆转录。对逆转录产物采用SYBR Green Master Mix反应体系进行q-PCR检测。U6作内参,检测各组细胞lncRNA MALAT1、miR-124-3p相对表达。反应体系总量20μL。cDNA产物2μL、上下游引物各0.5μL(10μmol/L)、SYBR Green Mix 10μL。反应条件:95℃ 预变性5min,94℃ 30s,60℃ 30s,72℃ 30s,共40个循环。测定每个样本的Ct值,循环数法(2-ΔΔCt)定量相对表达量。每组样本或细胞检测3次,取平均值。
1.2.4Westernblotting检测SOX7表达离心收集细胞,蛋白提取试剂盒提取细胞总蛋白,BCA试剂盒测定蛋白浓度,每孔50μg上样,10% SDS-PAGE凝胶分离1h,转膜,用含5%脱脂奶粉的PBS缓冲液封闭1h,加入SOX7一抗(1∶1000),4℃过夜,PBST缓冲液漂洗3次,每次5min,加入SOX7二抗(羊抗兔),37℃孵育4h。PBST缓冲液漂洗3次,β-Actin作内参,显色,成像,Image J分析目的蛋白的灰度值。实验重复3次。
1.2.5CCK-8法检测hRMECs增殖活力胰酶消化对数生长期的各组细胞,96孔板接种细胞,接种量5×104个/孔,每孔加100μL培养基,在48h后,更换新鲜培养基。检测前每孔加入20μL CCK-8试剂,1h后,用酶标仪测定450nm波长处的吸光值(D450nm);
每组3个复孔,每孔在相同条件下检测3次。
1.2.6Transwell实验检测hRMECs迁移能力将各实验组细胞与对照组细胞用胰酶处理,用1% FBS的完全培养基将细胞稀释至密度1×105cell/mL,接种于Transwell小室24孔板,上室加200μL细胞悬液,下室加500μL含10% FBS的培养基,37℃、5% CO2培养48h,取出小室,用棉签除去微孔膜上室的细胞,PBS上下冲洗2遍,微孔膜下细胞用5%的多聚甲醛固定15min,0.5%结晶紫溶液染色15min,显微镜下随机选取10个视野(100×),对细胞进行记数;
实验重复3次,取平均值。
1.2.7体外培养成管试验检测hRMECs血管形成能力取96孔培养板每孔加入50μL Matrigel胶(1∶2与预冷2%血清DMEM稀释),置37℃培养箱内30min使其凝固,将各组视网膜血管内皮细胞接种于包被Matrigel的96孔板(接种细胞数为1×105),置于5% CO2、37℃箱内孵育;
48h后,吸去培养基,并用PBS清洗2遍;
每孔1mL加入2μmol/L钙黄绿素的HBSS溶液,在37℃孵育1h;
用PBS缓冲液洗2遍;
荧光显微镜观察管状结构的形成情况并拍照;
Image J计算形成管状结构的面积(成管率=管状结构的面积/培养孔面积×100%)。其中,每组细胞接种3个复孔,结果取平均值。
1.2.8双荧光素酶报告基因验证miR-124-3p与lncRNAMALAT1和SOX7的靶向作用关系StarBase数据库预测结果表明,lncRNA MALAT1与miR-124-3p、miR-124-3p与SOX7之间可能存在直接靶向作用关系。将lncRNA MALAT1、SOX7与miR-124-3p的可能靶序列及其突变体片段插入Firefly荧光素酶报告基因下游,构建相应的表达载体。将miR-124-3p mimics与pmirGLO-lncRNA MALAT1-WT/MUT或pmirGLO-SOX7-WT/MUT共转染到HEK293细胞。对照组用miR-124-3p scramble与pmirGLO-lncRNA MALAT1-WT/MUT或pmirGLO-SOX7-WT/MUT共转染。转染实验完成后,细胞继续培养48h,测荧光强度。每个转染组重复3次实验,以3次荧光强度的平均值作为每组的结果数据。
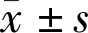
2.1lncRNAMALAT1在DR患者血清中高表达可能与高血糖相关qRT-PCR实验结果显示,与正常组患者相比,糖尿病组患者血清lncRNA MALAT1的表达显著升高,差异有统计学意义(t=10.48,P<0.001)。与糖尿病组患者相比,糖尿病视网膜病变组患者血清中lncRNA MALAT1的表达均显著升高,差异有统计学意义(t=8.33,P<0.001),见表1。由此推测,lncRNA MALAT1表达水平上调可能与糖尿病视网膜病变的发生相关。

表1 qRT-PCR检测lncRNA MALAT1的表达水平
2.2葡萄糖对hRMECs增殖及迁移和血管生成的影响体外培养hRMECs细胞发现,与阴性对照组相比,正常对照组(5mmol/L)lncRNA MALAT1的表达水平无显著差异(t=0.41,P=0.704)。与正常对照组(5mmol/L)相比,葡萄糖组1(15mmol/L)、葡萄糖组2(25mmol/L)和葡萄糖组3(35mmol/L)lncRNA MALAT1的表达水平呈浓度依赖性上升(t=6.10、18.57、18.52,均P<0.001)。由此进一步表明,lncRNA MALAT1表达上调可能与高血糖相关。CCK-8检测结果发现,与阴性对照组相比,正常对照组(5mmol/L)hRMECs增殖活力无显著差异(t=0.13,P=0.905)。与正常对照组(5mmol/L)相比,葡萄糖组1(15mmol/L)hRMECs增殖活力无显著差异(t=2.723,P=0.053),而葡萄糖组2(25mmol/L)和葡萄糖组3(35mmol/L)hRMECs增殖活力显著升高(t=2.83、2.98,均P<0.05)。Transwell实验结果表明,与阴性对照组相比,正常对照组(5mmol/L)hRMECs迁移能力无显著差异(t=0.59,P=0.588)。与正常对照组(5mmol/L)相比,葡萄糖组1(15mmol/L)、葡萄糖组2(25mmol/L)和葡萄糖组3(35mmol/L)hRMECs迁移能力均显著提高(t=12.85、25.24、25.92,均P<0.001)。此外,体外成管能力结果显示,与阴性对照组相比,正常对照组(5mmol/L)管形成能力无显著差异(t=0.49,P=0.652)。与正常对照组(5mmol/L)相比,葡萄糖组1(15mmol/L)、葡萄糖组2(25mmol/L)和葡萄糖组3(35mmol/L)对hRMECs成管能力显著提升(t=10.06、20.83、21.37,均P<0.001)。且葡萄糖组2(25mmol/L)和葡萄糖组3(35mmol/L)在对hRMECs增殖活力、迁移和管形成无显著差异(t=1.085、0.61、0.61,P=0.339、0.573、0.573),见图1,表2,因此,后续实验葡萄糖组浓度采用25mmol/L进行。由此可见,高浓度葡萄糖可在一定程度上促进hRMECs的增殖、迁移和血管生成。

图1 葡萄糖显著促进hRMECs迁移和成管能力 A:Transwell检测细胞迁移;
B:血管形成实验检测成管能力。

表2 葡萄糖显著促进lncRNA MALAT1 mRNA表达及hRMECs增殖、迁移和血管生成
2.3敲低lncRNAMALAT1显著抑制hRMECs增殖及迁移和成管能力qRT-PCR检测结果显示,与正常对照组(5mmol/L)相比,葡萄糖组2(25mmol/L)lncRNA MALAT1的表达水平显著升高(t=11.02,P<0.001)。与葡萄糖组2(25mmol/L)相比,敲低lncRNA MALAT1后则显著降低(t=13.97,P<0.001)。CCK-8实验结果表明,与正常对照组(5mmol/L)组相比,葡萄糖组2(25mmol/L)hRMECs的细胞活力显著增强(t=3.53,P=0.024)。与葡萄糖组2(25mmol/L)相比,敲低lncRNA MALAT1减弱了葡萄糖对hRMECs增殖活力的促进作用(t=5.02,P=0.0074)。Transwell和体外成管培养检测结果分别表明,与正常对照组(5mmol/L)相比,葡萄糖组2(25mmol/L)hRMECs的迁移能力显著增强、成管率显著上升(t=29.43、23.88,均P<0.001)。与葡萄糖组2(25mmol/L)相比,敲低lncRNA MALAT1后则逆转了这一过程(t=18.37、19.60,均P<0.001),见图2,表3。由此可见,敲低lncRNA MALAT1可显著抑制葡萄糖对hRMECs增殖、迁移和血管生成能力的促进作用。

表3 敲低lncRNA MALAT1显著抑制hRMECs增殖、迁移和成管能力

图2 敲低lncRNA MALAT1显著抑制hRMECs迁移和成管能力 A:Transwell检测细胞迁移;
B:血管形成实验检测成管能力。
2.4miR-124-3p与lncRNAMALAT1和SOX7的靶向作用关系StarBase网站预测结果显示,lncRNA MALAT1与miR-124-3p、miR-124-3p与SOX7可能存在靶向结合关系(图3A)。双荧光素酶报告基因实验结果表明,miR-124-3p mimics与pmirGLO-lncRNA MALAT1-WT、pmirGLO-SOX7-WT共转染实验组,荧光素酶活性显著低于miR-NC(miR-124-3p阴性对照)组(1±0.024vs0.39±0.042,1±0.082vs0.45±0.017,t=17.68、9.27,均P<0.001,图3B、C),而miR-124a-3p mimics与pmirGLO-IncRNA MALAT1-MUT、pmirGLO-SOX7-MUT共转染组,荧光素酶活性与miR-NC组相比无显著差异(1.01±0.065vs1.00±0.041,1.05±0.029vs1.04±0.031,t=0.12、0.11,P=0.909、0.916,图3B、C)。qRT-PCR检测结果显示,与sh-NC(sh-lncRNA MALAT1)组相比,sh-lncRNA MALAT1组miR-124-3p基因表达水平显著升高(0.99±0.034vs6.92±0.509,t=16.44,P<0.001,图3D)。Western blot检测结果显示,与miR-NC组相比,miR-124-3p mimic组SOX7蛋白表达水平显著性降低(1.26±0.072vs0.73±0.37,t=9.27,P<0.001,图3E)。总之,本研究结果表明,lncRNA MALAT1负调控miR-124-3p, miR-124-3p负调控SOX7。

图3 miR-124-3p与lncRNA MALAT1和SOX7的靶向作用关系 A:StarBase网站预测lncRNA MALAT1与miR-124-3p、miR-124-3p与SOX7靶向结合关系;
B:双荧光素酶报告基因检测证明lncRNA MALAT1和miR-124-3p靶向结合;
C:双荧光素酶报告基因检测证明miR-124-3p和SOX7靶向结合;
D:qRT-PCR检测miR-124-3p的表达水平;
E:Western blot检测SOX7蛋白表达水平。bP<0.01 vs miR-NC组;
dP<0.01 vs sh-NC组。
2.5lncRNAMALAT1通过miR-124-3p/SOX7分子轴促进hRMECs增殖及迁移和体外成管能力与Ⅰ组相比,Ⅱ组miR-124-3p表达显著下调(t=9.13,P<0.001)。与Ⅱ组相比,Ⅲ组miR-124-3p表达显著上调(t=11.27,P<0.001);
与Ⅲ组相比,Ⅳ、Ⅴ、Ⅵ组miR-124-3p表达显著下调(t=9.89、8.10、8.87,均P<0.01)。CCK-8实验结果表明,与Ⅰ组相比,Ⅱ组细胞增殖活力显著升高(t=3.18,P=0.033)。与Ⅱ组相比,Ⅲ组细胞增殖活力显著下降(t=3.30,P=0.030);
与Ⅲ组相比,Ⅳ、Ⅴ、Ⅵ组细胞增殖活力显著升高(t=3.84、3.03、3.00,P=0.019、0.039、0.040)。Transwell实验结果表明,与Ⅰ组相比,Ⅱ组细胞迁移能力显著上升(t=45.32,P<0.001)。与Ⅱ组相比,Ⅲ组细胞迁移能力显著降低(t=61.24,P<0.001);
与Ⅲ组相比,Ⅳ、Ⅴ、Ⅵ组细胞迁移能力显著提高(t=61.24、55.11、52.66,均P<0.001)。管形成实验结果表明,与Ⅰ组相比,Ⅱ组细胞管形成能力显著提高(t=25.27,P<0.001)。与Ⅱ组相比,Ⅲ组细胞管形成能力显著降低(t=28.86,P<0.001);
与Ⅲ组相比,Ⅳ、Ⅴ、Ⅵ组细胞管形成能力显著提高(t=28.06、20.79、27.20,均P<0.001),见图4,表4。进一步分析发现miR-124-3p与lncRNA MALAT1和SOX7的靶向结合序列相同,由此可知lncRNA MALAT1与SOX7竞争结合miR-124-3p,降低miR-124-3p对SOX7负调控作用,促进hRMECs增殖、迁移和血管形成。

图4 lncRNA MALAT1通过miR-124-3p/SOX7分子轴促进hRMECs迁移和成管能力 A:Transwell检测细胞迁移;
B:血管形成实验检测成管能力。

表4 lncRNA MALAT1通过miR-124-3p/SOX7分子轴促进hRMECs增殖、迁移和体外成管能力
高血糖可能是诱发DR的一个重要因素,DR患者长期的高血糖可能直接或间接促进视网膜血管形成和血液-视网膜屏障的破坏[15]。近年研究表明lncRNA参与了DR的发生和发展,DR患者血浆中异常表达的lncRNA可能成为一种新的预后指标和治疗靶点[16]。lncRNA MALAT1是一个与在眼部疾病发生发展相关的lncRNA。lncRNA MALAT1在糖尿病性白内障患者前晶状体囊组织中高表达,体外葡萄糖处理显著促进lncRNA MALAT1在人晶状体上皮细胞中的表达,并通过激活p38/MAPK信号通路促进晶状体上皮细胞HLECs的凋亡和氧化应激[17]。增殖性玻璃体视网膜病变(PVR)中,lncRNA MALAT1在视网膜色素上皮(RPE)细胞中高表达,并促进RPE细胞的增殖和迁移[18]。最近研究表明lncRNA MALAT1可作为筛查DR和NPDR早期诊断以避免进展为PDR的无创生物标志物[19]。lncRNA MALAT1在糖尿病小鼠视网膜、高糖处理的RF/6A细胞以及糖尿病患者的体液样本中均显著上调[20]。体外实验中敲低lncRNA MALAT1显著抑制内皮细胞增殖,体内实验中lncRNA MALAT1基因敲除降低新生小鼠视网膜血管生成[21]。由上述多项研究结果可知lncRNA MALAT1在DR中高表达可能促进视网膜微血管的形成。miRNAs参与糖尿病及其慢性并发症的发病机制,异常表达的miRNAs可作为糖尿病并发症发生发展的生物标志[22-23]。DR患者中异常表达的miRNA参与细胞增殖、迁移、凋亡、炎症反应、氧化应激及血管生成等生物学过程的调控。Walz等通过分析视网膜病变患者和正常人的miRNA的转录组发现10个异常表达的miRNA,其中,miR-124-3p在视网膜病变血管形成过程中表达水平显著下调[8]。体外实验发现miR-124-3p表达下调与癌细胞的增殖、迁移、上皮间质转化及血管形成等恶性生物学行为相关[24-26]。
SOX7是SOX家族成员之一,在细胞增殖、分化、迁移,血管生成等过程中具有重要调控作用。SOX7在血管内皮细胞中特异性表达,SOX7缺失导致胚胎致死性和小鼠血管生成严重受损[27]。SOX7在调控血管形成的主要途径,包括VEGF/Flk1信号通路、Wnt信号通路和Notch通路[12];
同时,SOX7作为VEGF信号的正反馈调节因子,促进血管生成[28]。
本研究发现,lncRNA MALAT1在DR患者血浆中高表达,体外高浓度的葡萄糖培养显著促进lncRNA MALAT1在hRMECs中的表达,lncRNA MALAT1通过降低miR-124-3p对SOX7的负调控作用而促进葡萄糖诱导的hRMECs增殖、迁移和血管形成。因此,在DR患者中抑制lncRNA MALAT1的水平可能有助于缓解视网膜微血管功能障碍。
猜你喜欢 试剂盒葡萄糖视网膜 深度学习在糖尿病视网膜病变诊疗中的应用现代仪器与医疗(2022年2期)2022-08-11如何防治裂孔性视网膜脱离老友(2022年4期)2022-05-18医生手术后“豪饮”葡萄糖注射液 一般人能喝吗保健与生活(2021年4期)2021-02-22视网膜脱离相关知识,你了解多少?农村百事通(2021年12期)2021-01-17糖尿病患者能吃氨基葡萄糖吗家庭百事通·健康一点通(2020年11期)2020-11-30为什么确诊新冠肺炎需要核酸检测试剂盒?保健与生活(2020年6期)2020-03-20视网膜脱离能治好吗保健与生活(2019年12期)2019-07-31一次检测多个基因,让肺癌诊疗更精准恋爱婚姻家庭·养生版(2019年1期)2019-01-2518F—FDG配套试剂盒的开发中国卫生产业(2018年12期)2018-05-14超/亚临界水中还原糖分解特性哈尔滨理工大学学报(2014年3期)2015-01-04栏目最新:
- 2024年度在理论学习中心组关于群众路线...2024-01-16
- 在退役军人事务工作领导小组会议上讲话...2024-01-15
- 中秋国庆队伍教育管理工作动员部署会议...2024-01-15
- 2024年度区委书记在文旅农康融合发展大...2024-01-14
- 医院纪检监察干部队伍教育整顿个人党性...2024-01-14
- 教师演讲稿:牢记育人使命,涵养高尚师德...2024-01-13
- 2024年组织部长在市委理论学习中心组专...2024-01-13
- 2024年区人民法院案件质量评查办法(2篇...2024-01-13
- 2024年区长在指导某街道干部作风建设动...2024-01-11
- 在公司成立周年大会上讲话(3篇)(完整...2024-01-10
相关文章:
