基于rMKL-LPP方法的乳头状肾细胞癌多组学数据整合分型分析*
李灵梅 魏亿芳 李 治 房瑞玲 崔跃华 曹红艳,4△
【提 要】 目的 探讨局部保留投影的正则化多核学习(regularized multiple kernel learning with locality preserving projections,rMKL-LPP)在乳头状肾细胞癌(papillary renal cell carcinoma,PRCC)多组学数据分子分型中的应用,进一步研究PRCC分子分型在信号通路活性和基因表达调控方面的异质性。方法 采用rMKL-LPP方法对PRCC的mRNA、miRNA和DNA甲基化数据进行整合,进一步采用k-means方法聚类分型,并通过Cox回归分析研究不同分型的预后风险。针对不同分型,进行通路活性分析,使用差异表达分析筛选DEmRNAs(differentially expressed mRNAs),DEmiRNAs(differentially expressed miRNAs)和DMGs(differentially methylated genes),并对三者的重合基因进行GO(gene ontology)富集分析,最后使用相关及生存分析筛选可能受DNA甲基化或miRNA调控且影响患者生存的基因。结果 PRCC患者分为三型,不同亚型在通路活性和基因表达方面均有差异。筛选出10条活性存在差异的通路;
1185个DEmRNAs,13个DEmiRNAs及416个DMGs,其中36个重合基因富集于有统计学差异的8个GO生物项。相关分析发现,ABL2可能受hsa-miR-107调控,13个基因可能受DNA甲基化调控。生存分析表明,ZNF135和RBPMS2可能与患者生存结局相关。结论 rMKL-LPP能够有效识别PRCC亚型,筛选出的通路及潜在生物标志物,可为PRCC针对性治疗提供依据。
乳头状肾细胞癌(papillary renal cell carcinoma,PRCC)是肾细胞癌(renal cell carcinoma,RCC)的第二常见亚型,占RCC病例的10%~15%[1]。PRCC具有很强的异质性,组织学上通常分为两型:Type Ⅰ和Type Ⅱ。其中,Type Ⅰ型属于低级别肿瘤,Type Ⅱ型属于高级别肿瘤[2]。Type Ⅱ较Type Ⅰ异质性更强,预后更差[3],可分化为高度恶性的RCC肉瘤样型[4]。该组织学分型常用于传统临床对PRCC患者进行预后评估,然而同一组织类型且临床分期相近的患者即使采用相同的治疗手段,其治疗效果和预后结局亦相差较大,评估效果并不理想。随着测序技术的发展,积累了大量组学数据,从组学层面研究癌症分子分型随之兴起。整合多组学数据不仅能够捕获PRCC不同组学的异质性,同时还可获得组学间的关联信息[5],从多层面揭示疾病的复杂调控机制。如何利用组学数据对患者精准分型,为治疗方案的选择及预后评估提供帮助,进而实现精准治疗,是PRCC临床治疗的重要发展方向。
TCGA研究组[3](2016)采用COCA方法[6](cluster-of-clusters analysis)综合PRCC患者的miRNA/mRNA、拷贝数变异、蛋白表达数据及DNA甲基化数据,首次对PRCC患者进行了分子分型。COCA是一种两步聚类法,首先基于不同数据类型的聚类结果构建一个二进制矩阵,然后输入该矩阵进行一致性聚类,得到一个综合不同数据集的全局聚类结构。然而,COCA属于后期整合方法,在对每个组学数据进行单独聚类时,易损失较弱的数据信号[7],而且在组合不同数据的聚类结构时未能考虑不同组学对分型的贡献[8]。而基于多核学习[9]的方法,将不同n×pi的组学数据分别转换为n×n的样本相似矩阵,通过学习优化,得到最优样本相似矩阵的线性组合,能够反映不同类型数据的权重,在多组学数据整合分型中独具优势。Speicher等[10]将多核学习与局部保留投影降维方法[11](locality preserving projections,LPP)结合,提出了rMKL-LPP。rMKL-LPP具有以下特点:(1)可基于数据类型灵活选择核函数;
(2)样本相似矩阵的权重即为不同组学数据的贡献度,反映了不同组学对分型的贡献;
(3)每个数据类型可设置多个核函数,避免了核参数设定的局限性。此外,Rappoport和Shamir[7]研究不同整合方法在10种TCGA癌症分型中的应用时,指出rMKL-LPP相比其他方法,更能有效识别出与临床特征及生存率显著相关的分子亚型。
因此,本文采用rMKL-LPP算法,整合PRCC患者mRNA、miRNA及DNA甲基化数据进行分型,并寻找不同分型的重要通路及差异表达基因,为实现乳头状肾细胞癌不同分型的针对性治疗提供参考。
1.数据来源
使用R包TCGAbiolinks[12]下载PRCC的mRNA、miRNA、DNA甲基化及临床数据,进行ID匹配后,得到表达矩阵:56493×219的mRNA矩阵、1881×219的miRNA矩阵及485577×219的DNA甲基化矩阵,其中行表示每个组学数据的特征,列表示样本。数据预处理方法如下:(1)对启动子区域CpG甲基化位点进行注释,启动子区域为转录起始位点2kbp内的区域[13],进一步去除性染色体上的启动子区CpG位点。(2)删除缺失比例大于30%的特征,用KNN(k-nearest neighbors)算法填补剩余缺失值,并对mRNA和miRNA数据进行log2转换。最终得到16534个mRNA,437个miRNA和49022个DNA甲基化位点。
2.分析方法
多核学习降维(multiple kernel learning for dimensionality reduction,MKL-DR)方法[14]通过使用核函数,将不同数据集映射到高维空间并进行集成,然后通过降维算法将集成结果映射到低维空间,进行后续分析[15]。rMKL-LPP在MKL-DR的基础上,采用LPP进行降维,同时为了避免优化问题中的过拟合,加入了正则约束项。方法原理如下:
(1)多核学习
多核学习将M个给定的基本核函数{k1,…,kM}线性组合,通过优化权重系数得到一个融合核K,如公式(1)所示。
(1)
其中Km表示基本核函数,βm是核函数Km的权重系数。
(2)局部保留投影降维LPP
LPP是一种基于图嵌入框架的无监督方法,旨在寻找最优投影向量v,使得经v映射后,样本在优化空间中仍然能够保持高维空间中的近邻关系。v根据图保留准则(graph-preserving criterion)进行优化:
(2)
(3)
(4)
(5)
其中xi和xj表示第i和j个样本,元素wij构成相似矩阵W,元素dij组成约束矩阵D,Nk(i)和Nk(j)为数据点i和j的最近邻数。
(3)引入正则约束的优化

(6)
其中α是一维情况下的投影向量,Ki为集成空间,β是核函数的权重向量。对于多维数据,将针对投影矩阵A=[α1…αp]进行优化,并采用坐标下降法交替对A与β进行迭代优化,直到达到收敛或最大迭代次数。若从优化A开始,令所有核矩阵权重β数值相同,且总和为1;
若从优化β开始,AAT应初始化为I。
(4)k-means聚类
rMKL-LPP通过LPP将集成结果投影到低维空间,进一步采用k-means方法进行聚类分型,并根据轮廓系数选择最优分型数。
(5)rMKL-LPP参数选择

3.基于PRCC分型结果的下游分析
(1)Cox回归分析
控制初始诊断年龄、性别和病理诊断分期等情况下,采用Cox回归分析对PRCC患者的分型结果进行预后评估。
(2)通路活性分析
利用progeny软件包[16]对不同亚型进行通路活性分析,并采用非参数检验筛选活性存在差异的通路,筛选标准为Padj<0.01。
(3)差异基因筛选
采用Kruskal-Wallis秩和检验筛选DEmRNAs、DEmiRNAs及DMGs,阈值设为Padj<0.01;
进一步采用超几何分布检验[17]筛选在每个分型上富集的特征,筛选标准为Padj<0.01。为选择最具代表性的特征,要求特征在该分型中至少有2/3的样本发生改变,同时至少在一个其他分型中少于1/3样本发生改变,按此标准选出的特征即为最终的差异基因。
(4)GO富集分析
利用miRWalk[18]在线工具预测DEmiRNAs的靶基因,进一步采用clusterprofile R包[19]对DEmRNAs、DEmiRNAs靶基因及DMGs的重合基因进行富集分析。
(5)相关分析
分别对DEmRNAs与DMGs的重合基因,DEmRNAs与DEmiRNAs靶基因的重合基因进行Pearson相关分析,根据相关系数r和P值筛选出可能受DNA甲基化负调控的基因,筛选标准为-1.0
(6)基因生存分析
对可能受DNA甲基化或miRNA调控的基因进行生存分析。根据基因表达水平将患者分为高表达组和低表达组,应用Kaplan-Meier生存分析筛选与患者生存相关的基因,筛选标准为P<0.05。
1.PRCC患者分型结果评价
采用rMKL-LPP对219名PRCC患者的组学数据进行整合分析,最优分型数为4(图1),生存曲线见图2,不同分型患者的生存率存在差异(χ2=89.566,P<0.0001)。经Cox回归分析发现,Cluster2和Cluster3生存率差异无统计学意义(χ2=0.050,P=0.823)。因此,将Cluster2和Cluster3合并成为一个新的Cluster2,三组基本资料见表1,生存曲线见图3。结果显示,Cluster3患者相比于其他两型,预后差,说明基于rMKL-LPP的分型与PRCC患者生存相关。

图1 PRCC分型结果的三维图

图2 PRCC分为四型的生存曲线图

图3 PRCC分为三型的生存曲线图

表1 PRCC患者分型的基本资料
在校正协变量的情况下,研究不同分型对预后的影响,即分型作为自变量,生存时间和生存状态作为因变量,拟合Cox回归模型,结果如表2,预后最差的Cluster3患者的死亡风险是Cluster1的47.731倍,Cluster2患者的死亡风险是Cluster1的6.143倍;
病理分期差异有统计学意义,Ⅳ期患者死亡风险是Ⅰ期患者的20.351倍。

表2 219例PRCC患者的Cox回归分析结果
2.通路活性分析
对PRCC亚型进行通路活性分析,存在差异的10条通路如图4所示,其中TGF-β、EGFR、NF-Kβ、MAPK、Hypoxia、TNF-α和PI3K通路在Cluster3中活性最高;
通路Wnt和VEGF在Cluster2中活性最高,Estrogen通路在Cluster1中活性最高。不同分型通路活性的差异也在一定程度上反映了PRCC不同亚型的异质性。
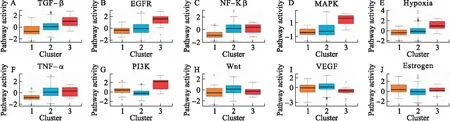
图4 PRCC不同亚型的差异通路
3.差异基因筛选及分析
(1)差异基因的筛选结果
筛选出1185个DEmRNAs,其中上调626个,下调559个;
459个差异甲基化位点映射到416个DMGs,包括111个高甲基化基因和305个低甲基化基因;
筛选出13个DEmiRNAs,其中2个上调,11个下调。图5依次为DEmRNAs,DMGs及DEmiRNAs表达热图,从图中可以明显看出这些特征在不同亚型中的表达差异。

图5 不同亚型中差异基因表达热图
对13个DEmiRNAs进行预测得到36个靶基因,通过对DEmRNAs,DMGs以及36个DEmiRNAs靶基因进行联合分析,发现DEmiRNAs靶基因与DEmRNAs有1个重合基因,DMGs与DEmRNAs有35个重合基因(图6)。

图6 差异基因的韦恩图
(2)GO富集分析
为进一步验证基于rMKL-LPP分型的生物学意义,对联合分析得到的重合基因进行富集分析。36个重合基因富集于8个GO生物项,见图7,基因与GO生物项的关系如图8所示。GO富集分析可从生物过程(biological process,BP)、分子功能(molecular function,MF)和细胞组成(cellular component,CC)等三部分对基因及基因产物进行注释。8个GO生物项主要体现在生物过程和细胞组成两个方面。图7中8个GO生物项纵轴自上而下依次为中胚层发育、色氨酸分解过程、含吲哚化合物分解代谢过程、吲哚烷基胺分解过程、色氨酸代谢过程、吲哚烷基胺代谢过程、顶端质膜与细胞的顶端部分。图中实心圆的大小表示富集于该通路基因的数量。

图7 GO通路分析图

图8 基因与8个GO生物项的网络关系图
(3)相关分析
对DEmRNAs与DMGs重合基因进行相关分析,最终得到13个存在相关关系的基因,即可能受DNA甲基化调控的基因,如图9所示。基因在不同亚型表现出不同的相关关系,如ZNF135仅在Cluster1中存在相关关系;
而RBPMS2仅在Cluster3中存在相关关系。对DEmRNAs与DEmiRNAs靶基因的重合基因进行相关性分析,发现ABL2仅在Cluster2中与hsa-miR-107存在负相关关系(图9)。基因之间的相关关系表明基因间可能存在生理学调控作用。

图9 重合基因相关关系热图
(4)基因生存分析
对可能受DNA甲基化或miRNA调控的基因进行生存分析,最终得到2个可能影响PRCC患者预后的基因,如图10所示。在Cluster1中,ZNF135低表达组患者的总生存期低于高表达组;
在Cluster3中,RBPMS2高表达的患者较低表达的患者预后更差。

图10 基因ZNF135与RBPMS2的生存曲线图
本文采用rMKL-LPP方法对PRCC多组学数据进行整合分型,将PRCC患者分为三型,不同分型在通路的活性、基因表达调控方面均有差异。基于分型得到的潜在生物标记物(基因或信号通路),将为PRCC针对性的干预治疗提供重要的参考依据。
PRCC患者分为三型,Cluster1与Cluster2型PRCC发病年龄在60~65岁,且男性居多,与大多数病例的高发年龄、性别构成基本吻合[20]。预后最差的Cluster3型患者初始诊断年龄偏小,且在女性中更为常见。结合三个亚型来看,发病年龄越早的患者预后越差,而且不同性别的患者高发年龄可能不一致。对此,临床上应予以重视,多关注小于50岁的患者,同时加强对女性患者的筛查和评估,及时进行干预。本研究女性样本含量较小,有关PRCC年龄及性别的差异仍需进一步研究。
不同亚型信号通路活性的差异可帮助理解PRCC异质性的分子基础。通路TGF-β、EGFR、NF-Kβ、MAPK、Hypoxia、PI3K和TNF-α在Cluster3中活性最高。其中TGF-β可通过诱导患者上皮间质转换来促进RCC发展[21]。EGFR通路在肾脏发育过程中起关键作用,可能是PRCC一个潜在的治疗方向[22]。通路NF-Kβ和MAPK可调节RCC细胞增殖、侵袭和迁移[23-24]。Hypoxia通路作为肾癌的主要驱动因素被广泛研究,与透明细胞肾细胞癌关系密切[25-26]。PI3K在RCC中可加速细胞周期,促进肿瘤细胞迁移[27],据此,可通过抑制PI3K/AKT信号通路来阻止RCC的生长和转移[28]。TNF-α通路可为癌细胞的激活、分化、侵袭和增殖提供信号,促进癌症发展[29-30]。可见,这些通路的异常激活可能与Cluster3不良预后相关。此外,Wnt通路的异常激活可促进RCC的转移和恶化[31]。而VEGF和Estrogen通路可影响肾癌的发生发展[32-33],其对于PRCC靶向治疗的意义有待进一步挖掘。
本研究基于PRCC分子分型得到三个可能受DNA甲基化或miRNA调控且影响患者生存的基因ABL2、ZNF135与RBPMS2,这三个差异分子靶标与PRCC的关系尚不明确,但有研究发现它们与其他癌症有关。ABL2是一种原癌基因,可参与调控细胞生长、侵袭和迁移等过程[34],与肾细胞癌的发生发展相关[35]。ZNF135编码一种转录抑制蛋白,在透明细胞肾细胞癌、宫颈癌与乳腺癌等多种癌症中高度甲基化[36],本研究发现其在RPCC中也高度甲基化,具体作用机制有待进一步阐明。RBPMS2的高表达与胃肠道间质瘤有密切联系[37],还可促进乳腺癌的发生发展[38]。这些基因对PRCC的预后有一定的预测价值,有望作为PRCC未来药物治疗的潜在靶点,而且基因间的调控作用也值得进一步研究。
综上所述,本文基于rMKL-LPP方法对PRCC多组学数据的整合分析,能够有效地识别亚型,为PRCC的分型研究提供了新的思路。识别出的PRCC亚型在信号通路活性、基因表达及调控方面均存在差异,这有助于进一步理解不同分型发生发展的潜在分子机制。此外,筛选出的潜在生物标志物将为PRCC治疗和预后评估提供一定的理论依据和临床指导。
猜你喜欢 组学亚型甲基化 一种肿瘤甲基化谱纯化的统计方法朱宜静上海师范大学学报·自然科学版(2022年3期)2022-07-115-氮杂胞苷调节植物基因表达研究进展与应用展望中国农学通报(2022年13期)2022-05-312012—2018年长春市手足口病非肠道病毒A组71型肠道病毒V P1基因特征分析中国生物制品学杂志(2022年3期)2022-05-13影像组学在肾上腺肿瘤中的研究进展昆明医科大学学报(2022年3期)2022-04-19甲基苯丙胺改变成瘾小鼠突触可塑性基因的甲基化修饰昆明医科大学学报(2022年1期)2022-02-28植物DNA甲基化研究进展农学学报(2021年11期)2021-12-12尖锐湿疣患者感染HPV亚型的研究及临床分析皮肤病与性病(2021年3期)2021-07-30东莨菪碱中毒大鼠的代谢组学昆明医科大学学报(2021年4期)2021-07-23影像组学在核医学影像中的应用进展智慧健康(2021年33期)2021-03-16蛋白质组学技术在胃癌研究中的应用天津医科大学学报(2021年1期)2021-01-26栏目最新:
- 2024年度在理论学习中心组关于群众路线...2024-01-16
- 在退役军人事务工作领导小组会议上讲话...2024-01-15
- 中秋国庆队伍教育管理工作动员部署会议...2024-01-15
- 2024年度区委书记在文旅农康融合发展大...2024-01-14
- 医院纪检监察干部队伍教育整顿个人党性...2024-01-14
- 教师演讲稿:牢记育人使命,涵养高尚师德...2024-01-13
- 2024年组织部长在市委理论学习中心组专...2024-01-13
- 2024年区人民法院案件质量评查办法(2篇...2024-01-13
- 2024年区长在指导某街道干部作风建设动...2024-01-11
- 在公司成立周年大会上讲话(3篇)(完整...2024-01-10
相关文章:
