影响‘41B’葡萄体细胞胚诱导因素的研究
张凯,袁昀章,常欣玉,马靖,刘慧,陈文婷,谭君,杨国顺,白描*
(湖南农业大学园艺学院,湖南长沙 410128)
葡萄中体细胞胚(somatic embryo,SE)的诱导是最适宜的转基因途径之一[1],也是诱导体细胞无性系变异的重要策略。体细胞胚可超低温保存,用于研究胚胎发育以及获得无病毒植株[2-4]。体细胞胚发生包括胚性细胞(embryonic cell,EC)的获得、体细胞胚的诱导(somatic embryo induction,SEI)和胚性细胞的维持(embryonic cells maintenance,ECM)等过程。Mullins等[5]于1976年首次报道了‘赤霞珠’采用液体培养进行体细胞胚发生再生植株的方法。Krul等[6]在固体琼脂培养基条件下,从杂交葡萄‘Seyval’的愈伤组织中获得了体细胞胚。随后,其他品种也被证明能够诱导产生胚性细胞,不同的外植体如叶片、花药、合子胚、子房和种子等被用于胚性细胞的获得,并进行体细胞胚的诱导[1,7-8]。在液体培养基中,可以获得大量体细胞胚,但大多数胚胎表现异常,很难恢复为正常的植株[9-10]。
在葡萄属植物中,未成熟的花药是应用最广泛的外植体,子房和全花也被证明适合体细胞胚发生,而其他外植体很少被使用[11-12]。近年来已经发布了一些体细胞胚发生的方案,其中‘41B’葡萄是早期发现具有很强再生能力的品种。‘41B’为欧美杂交种(Vitis viniferaChasselas×Vitis berlandieri),用其花药可培养出二倍体细胞。该细胞在悬浮培养中容易形成均匀的细胞团,扩繁培养方便,同时显示出良好的产生球形和心形胚胎的能力。但随后胚胎的进一步发育受阻,大部分成为畸形苗,只有少数能发育成正常苗[13]。
为明确‘41B’细胞再生能力的发生条件和作用机理,为其他品种的体细胞胚发生提供参考。本研究比较了不同物质或处理对‘41B’细胞的体细胞胚诱导的影响,对处理后体细胞诱导效率和同步性等进行了检测,研究结果可加深对限制葡萄体细胞发生因素的认识,也可为葡萄体细胞胚诱导相关研究试验处理的设置提供依据。
1.1 研究材料
‘41B’胚性细胞分离自其花药,来自中科院北京植物园代占武实验室。GM固体基本培养基(GMS)配方和配制方法参考文献[14],所用试剂均购自Sigma或索莱宝等公司。其中,植物琼脂(P1001)、1/2MS大量购自Duchefa;
反式玉米素核苷(ZR,Z3541)、6-苄基腺嘌呤(6-BA,B3408)、噻苯隆(TDZ,P6186)、甘油(G5516)、生物素(B4639)、烟酸(N0761)、硫胺素(T4625)、盐酸吡哆醇(P9755)、肌醇(I7508)均购买自Sigma。活性炭(activated charcoal,AC)、聚乙烯吡咯烷酮(PVP)、2,4-二氯苯氧乙酸(2,4-D,D8100)、萘氧乙酸(NOA,B8400)、透析膜(dialysis membranes,DM,Y1071)、脱落酸(ABA,A8060)、丁酸钠(NaB,IS0190)、麦芽糖(D8110)和蔗糖均购自索莱宝公司。
1.2 研究方法
‘41B’胚性细胞的维持和扩繁采用GMS+1 mg·L-1NOA(pH=6.8)培养基,置于25 ℃培养箱,黑暗条件下培养。体细胞胚诱导培养条件:将细胞置于25 ℃,光强4000 Lux的培养箱中,光周期为16 h/8 h(光照/黑暗)。
‘41B’细胞在GMS基础培养基上进行体细胞胚诱导。GMS基础培养基为:1/2MS+微量(0.05 mg·L-1生物素+0.5 mg·L-1硫胺素+5 mg·L-1烟酸+0.5 mg·L-1盐酸吡哆醇+100 mg·L-1肌醇)+4.6 g·L-1甘油+18 g·L-1麦芽糖+7 g·L-1琼脂。以GMS为基本培养基,在其基础上进行设置(表1),化合物浓度(标注)如下:1 g·L-1PVP(P1);
3 g·L-1(AC3)或6 g·L-1(AC6)活性炭;
1 mg·L-1或2 mg·L-1的三种不同类型的细胞分裂素(分别标注为ZR1、ZR2;
TDZ1、TDZ2;
6-BA1、6-BA2);
透析膜(DM);
0.05 g·L-1(NaB0.05)和0.5g·L-1(NaB0.5)的丁酸钠;
0.1 mg·L-1(ABA0.1)或1 mg·L-1(ABA1)脱落酸;
添加20 g·L-1蔗糖(S20)或将甘油和麦芽糖替换为20 g·L-1(GMS(-G/M)+S20)或60 g·L-1(GMS(-G/M)+S60)蔗糖。
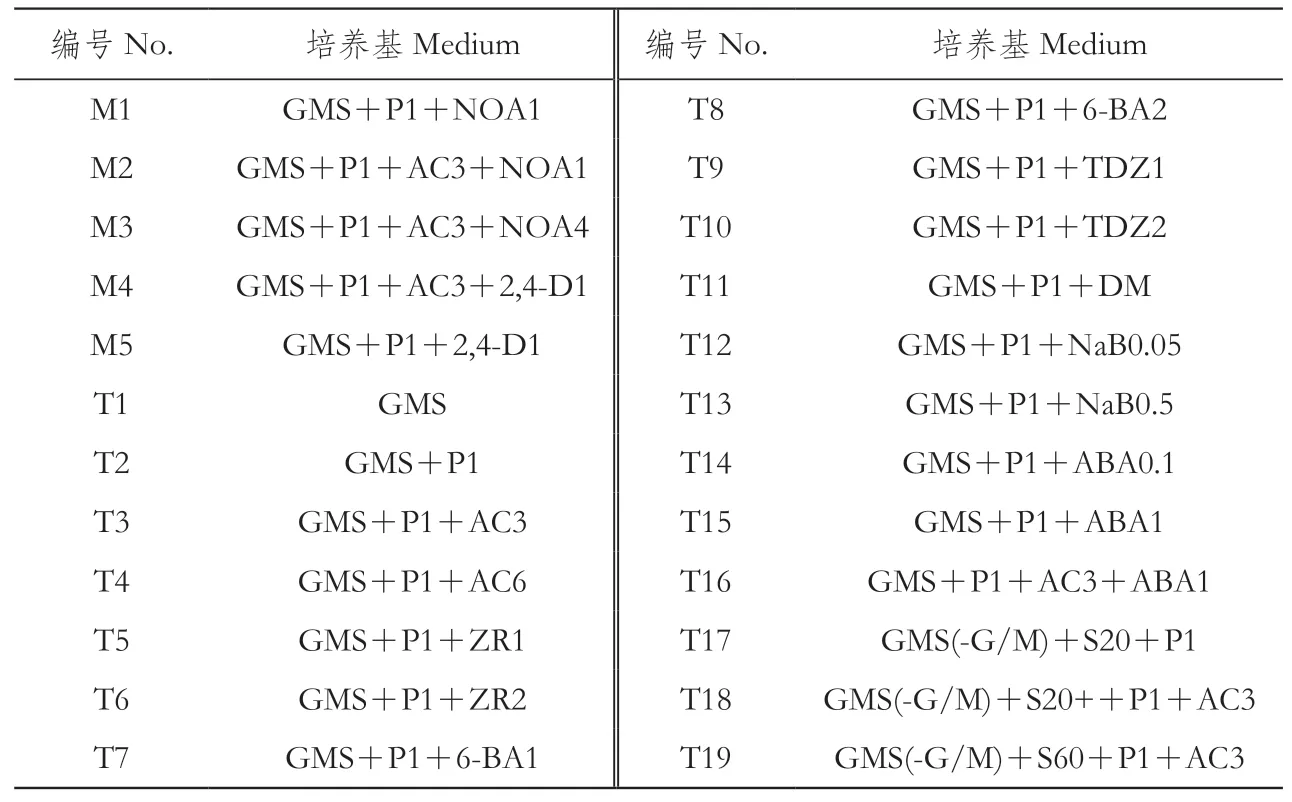
表1 所采用的培养基Table 1 Media used in this study
在超净工作台上,接种‘41B’细胞。接种量为每个平板(9 cm×2 cm)接种100 µL细胞(在1 g离心率下沉降),用勺子摊平,直径约为5 cm。接种细胞后,每天用体视显微镜(OLYMPUS,SZX7)进行观察,并记录生长状态。不同类型的细胞状态不同:‘41B’胚性细胞整体上呈黄色疏散状,非胚性细胞/愈伤呈现白色透明松软状,体细胞胚(球形胚)呈现白色致密球状。
由于原接种细胞和形成球形胚的数目很难定量,为表征SEI速度和同步性,将形成球形胚占接种细胞面积的百分比来进行观察统计。每天观察记录,重复3次。文中FD:表示开始发现有球形胚时所经历的天数;
FD>10%:表示当细胞中球形胚达到总体细胞团面积的10%左右时所经历的天数;
FD>50%:表示当细胞中球形胚达到总体细胞团面积的50%左右时所经历的天数;
RSE/30 d:指培养30 d后球形胚占胚性细胞总体细胞团面积的比率。同时对‘41B’细胞褐化程度进行排序:0代表该细胞状态良好,所有细胞呈现淡黄色,几乎没有褐化;
1代表细胞有褐化出现;
5代表有一定程度(0~10%)褐化;
7代表中度(10.01%~15%)褐化和9代表出现严重(>25%)褐化。
2.1 葡萄体细胞胚形成的各个阶段
‘41B’体细胞胚诱导过程中不同阶段细胞状态如图1所示。‘41B’葡萄胚性细胞维持在培养基M1(GMS+P1+NOA1)中(图1A)。在转入培养基T1(GMS)后,体细胞胚诱导经历了球形胚(图1B)、心形胚、鱼雷胚和子叶胚(图1C)以及胚萌发和成苗过程。球形胚为白色致密球状;
体细胞胚发育速度不一致,心形胚、鱼雷胚和子叶胚可能同时出现(图1D)。而在T1培养基上,几乎所有体细胞胚萌发后都为畸形(图1E和1F)。
2.2 活性炭和生长素对胚性细胞维持的影响
本研究对影响胚性细胞维持的条件进行了调查,在不同培养基上暗培养30 d后,结果发现:(1)活性炭(AC)除了显著抑制褐化外,其非选择性吸附作用对激素浓度的影响显著。胚性细胞(EC)可以在含生长素的培养基中维持(M2:GMS+P1+NOA1或M4:GMS+P1+2,4-D1);
但当有3 g·L-1AC存在时,即使含有NOA(1 mg·L-1或4 mg·L-1),EC也极易诱导为SE;
而1 mg·L-12,4-D对胚性细胞维持的作用不能被AC抑制(图2A)。(2)胚性细胞维持过程中不同生长素对后续体细胞胚的诱导影响不同。相对于NOA,2,4-D处理会抑制后续成胚能力(图2B),这可能与2,4-D在细胞中稳定而难以去除有关。
2.3 不同化合物对‘41B’体细胞胚诱导的影响
在不同处理后,每天记录各个处理球形胚所占的比例和褐化状态,持续观察30 d,统计结果如表2。
2.3.1 活性炭和PVP对葡萄体细胞胚诱导的影响
‘41B’细胞在T1培养基(GMS)中,细胞褐化较严重(图3A);
在添加PVP(T2)后对减轻细胞褐化有一定程度的改善,但不明显(图3B);
而添加3 g·L-1(T3)和6 g·L-1(T4)AC,细胞生长状态良好,几乎无褐化现象,且相对T2发育速度加快(图3C和3D)。AC对SEI速度有一定程度的提高(表2):T2(GMS+P1)和T3(GMS+P1+AC3)处理第12天左右开始成胚,分别培育18 d和21 d后成胚比例达到50%(表2),而T4(GMS+P1+AC6)处理第8天开始成胚,18 d后成胚比例达到50%。

表2 不同化合物或处理对葡萄体细胞胚诱导的影响Table 2 Effects of different compounds or treatments on grape somatic embryo induction
2.3.2 细胞分裂素对葡萄体细胞胚诱导的影响
‘41B’胚性细胞在含有1 mg·L-1或2 mg·L-1三种不同类型的细胞分裂素的培养基中培养发现,细胞分裂素显著抑制了SEI,且不同类型细胞分裂素具有一定差异(图3E-J)。ZR对SEI的抑制作用相对弱于6-BA和TDZ。两个浓度下6-BA和TDZ以及2 mg·L-1的ZR显著促进非胚性愈伤的形成。
2.3.3 丁酸钠对葡萄体细胞胚诱导的影响
低浓度NaB(0.05 g·L-1)的处理加速了SE的形成,但对体细胞胚比例无明显影响(图3K,表2)。高浓度NaB(0.5 g·L-1)对细胞具有杀伤作用,致使‘41B’细胞死亡(图3L)。另外,还尝试了在NaB(0.5 g·L-1)基础上添加AC(3 g·L-1),发现NaB没有完全致死细胞,但促进了非胚性细胞的增殖,进而抑制SEI。
2.3.4 透析膜对葡萄体细胞胚诱导的影响
将细胞置于透析膜(DM)上(T11:GMS+P1+DM)进行培养,结果发现,体细胞胚出现速度加快,在第8天就有出现;
但是在培养10 d后,开始干燥泛白、褐化严重,后期体细胞胚无法正常发育(表2,图3M);
DM外和DM上的胚性细胞有明显的区别,DM外或其边缘胚性细胞通过对培养基上营养和水分的吸收,在21 d后开始出现体细胞胚,且部分体细胞胚提前萌发(图3N),而在DM上的细胞出现脱水现象,这可能与透析膜两边,细胞和培养基之间的渗透压差太大有关。
2.3.5 ABA对葡萄体细胞胚诱导的影响
本研究调查了ABA对SEI的影响。发现随着浓度提高,ABA对SEI的抑制作用加剧,0.1 mg·L-1和1 mg·L-1ABA可显著抑制体细胞胚的形成,且抑制后续的萌发(图3O和3P);
但当有3 g·L-1AC存在时,1 mg·L-1ABA却加速了部分体细胞胚的萌发(图3Q)。由于不能确定AC浓度与吸附效率的关系,加上其吸附作用可能没有选择性,因此很难判断ABA的有效浓度。与未加ABA的对照(T2,图3B)比较,低浓度的ABA可能促进体细胞胚的萌发。
2.3.6 不同碳源及浓度对葡萄体细胞胚诱导的影响
GMS中碳源为麦芽糖和甘油,本研究以20 g·L-1蔗糖替换该碳源(T17:GMS(-G/M)+S20+P1),结果发现SEI起始没有明显加快,但后期速度加快,体细胞胚出现更加同步;
不过有部分体细胞胚发育加快,且有明显的褐化(表2,图3R)。在T17基础上添加AC后(T18),形成体细胞胚速度减慢,体细胞胚形成的同步性变差,且伴随部分非胚性细胞的增殖(表2,图3S);
而当蔗糖提高到60 g·L-1,SEI速度加快,且体细胞胚形成的同步性显著提高,SE呈乳白色,后续观察发现萌发速度显著减慢(表2,图3T)。
在SEI过程中,各种培养条件和化合物的使用被提及。首先,生长素被证明是胚性细胞维持的关键,而外源生长素去除是SEI的关键。在高浓度的生长素处理下,一些特定的细胞有机会获得再生能力,随后降低生长素浓度有利于胚性细胞诱导为体细胞胚[15-16]。‘41B’主要使用NOA进行胚性细胞的维持,而我们使用2,4-D进行比较发现,2,4-D处理会使细胞(团)形态发生变化,后续成胚能力受到严重抑制,这可能与2,4-D稳定不易迁移难以去除有关,也可能与不同类型生长素的作用机制差异有关。
在SEI过程中细胞褐化的抑制很重要。添加PVP和AC是细胞培养中防止褐化的重要手段[17]。但本研究发现,PVP对于‘41B’细胞褐化抑制效果并不明显,而AC效果显著。另外,AC也显著提高了SEI的速度和一致性,暗示AC可能吸附了一些抑制SEI的物质。在SEI过程中,众多研究都有添加AC的习惯,反而导致AC对SEI的关键作用被忽略[13,18]。本研究再次强调了AC在SEI中的重要性,同时需要注意由于AC的非选择性吸附,培养基中激素等添加物的有效浓度可能与无AC添加的培养基不同,其具体影响程度需要进一步研究。
前人研究发现,添加细胞分裂素有利于细胞再生[19],甲基化的去除可调控众多再生相关的基因。研究显示,采用组蛋白去乙酰化酶(HDAC)抑制剂NaB,对葡萄体细胞胚形成具有积极作用[20]。另外,水分的有效性对诱导体细胞胚很关键。体细胞胚的成熟与其储备产物的积累和干燥度有关。研究发现,透析膜的使用可以减少水分的可用性,显著提高柑橘和葡萄等体细胞胚的诱导率[21];
高浓度蔗糖和ABA的使用也可能调节水分的利用,从而促进体细胞胚的形成,而且ABA被证明能减轻体细胞胚的畸形率[22]。
在本研究中发现,不同类型细胞分裂素都对‘41B’细胞的再生没有积极作用,还会促进非胚性细胞的增殖。这提示,由基因型决定的具有高再生能力的葡萄类型或品种,无需细胞分裂素进行体细胞胚诱导。这可能与内源细胞分裂素浓度有关,但具体原因还有待证实。本研究发现,低浓度NaB可能促进体细胞胚的形成,但高浓度NaB可使细胞白化死亡。这暗示对组蛋白去乙酰化酶的强烈抑制,可能对细胞造成不可逆的损伤,在对其他种类或品种葡萄使用时应注意其浓度。另外,‘41B’葡萄的SE萌发后几乎都是畸形。这与前人研究结果不同[22],ABA对降低‘41B’葡萄SE的畸形率没有明显作用。
在SEI过程中,高浓度ABA抑制体细胞胚的形成和萌发,但在AC存在情况下,低浓度ABA则可能促进体细胞胚的萌发。AC对各类化合物可能具有非选择性吸附,从而降低其有效利用率,这对试验结果造成不可预测的影响,需引起重视。
最后,本研究发现,水分的利用对体细胞胚的形成影响显著,DM或高浓度的蔗糖都可能影响了水分的利用。但是,持续处于DM上的细胞容易过度失水,进而影响体细胞胚的发育;
而高浓度的蔗糖可提高体细胞胚的诱导效率和其生长的同步性。综上,活性炭和蔗糖的利用有利于葡萄体细胞胚的诱导,具有进一步深入研究的价值。
栏目最新:
- 2024年度在理论学习中心组关于群众路线...2024-01-16
- 在退役军人事务工作领导小组会议上讲话...2024-01-15
- 中秋国庆队伍教育管理工作动员部署会议...2024-01-15
- 2024年度区委书记在文旅农康融合发展大...2024-01-14
- 医院纪检监察干部队伍教育整顿个人党性...2024-01-14
- 教师演讲稿:牢记育人使命,涵养高尚师德...2024-01-13
- 2024年组织部长在市委理论学习中心组专...2024-01-13
- 2024年区人民法院案件质量评查办法(2篇...2024-01-13
- 2024年区长在指导某街道干部作风建设动...2024-01-11
- 在公司成立周年大会上讲话(3篇)(完整...2024-01-10
相关文章:
