消化道颗粒细胞瘤9例临床分析
吴晨霞 施红旗 崔海宏 黄 斌 张宝燕* 苏 杰 姜春婷 邱岳琳
中国人民解放军联勤保障部队第903医院病理科1(310013) 金华市中心医院医疗集团(医学中心)病理科2中国人民解放军第305医院消化科3 杭州市萧山区第一人民医院病理科4
背景:颗粒细胞瘤(GCT)少见,消化道GCT更少见。目的:探讨消化道GCT的临床病理学特点及其治疗和预后。方法:收集2017年1月—2021年6月联勤保障部队第903医院和金华市中心医院医疗集团(医学中心)收治的9例消化道GCT患者,回顾性分析患者的临床资料、病理学特征及其治疗方案和预后。结果:9例消化道GCT患者中,男女之比为2∶1;
发病年龄为19~60岁,中位年龄52岁;
发生于食管6例,结直肠2例,肛管1例。内镜示黏膜下隆起或无蒂息肉,肿瘤直径2~12 mm,中位直径5 mm。组织病理学检查示肿瘤位于黏膜层和(或)黏膜下层,呈实性团片状或巢状排列,周边呈浸润性生长;
间质有炎性细胞浸润;
瘤细胞呈胖梭形或多边形,胞质丰富,内含大量嗜酸性颗粒;
核小、核质比极低,核分裂象罕见。免疫组化示所有患者均表达S100和CD68,部分表达SOX10、CD56、Calretinin和Syn,不表达CKp、Desmin、SMA、CD117、CD34、Dog1和α-inhibin。食管和结直肠GCT均行内镜下黏膜切除术(EMR)或内镜黏膜下剥离术(ESD),肛管GCT行局部切除术。所有患者随访9~53个月,均未见肿瘤复发或转移。结论:消化道GCT少见,临床症状无特异性,内镜下多呈黏膜下隆起或无蒂息肉,有特征性病理形态和免疫表型。病变小且浅表者行EMR或ESD治疗,效果好,术后需长期随访。
颗粒细胞瘤(granular cell tumor, GCT)于1926年由俄国病理学家Abrikossoff首先报道,当时认为其来源于肌母细胞,现多认为其源于Schwann细胞、向神经外胚层方向分化的肿瘤。GCT约占软组织肿瘤的0.5%,好发于头颈部如舌、乳腺、近端肢带区,病变位置一般较浅表,常位于皮肤、皮下层或黏膜下层。胃肠道、呼吸道GCT少见,但随着内镜技术的普及,消化道GCT(不含口腔)检出率逐渐增加。本研究通过回顾性分析9例消化道GCT的临床特征,旨在加深对消化道GCT的认识,从而避免误诊、漏诊。
一、一般资料
收集并整理2017年1月—2021年6月在联勤保障部队第903医院(6例)和金华市中心医院医疗集团(医学中心)(3例)收治的9例消化道GCT患者的临床资料。所有病例均行常规组织病理学和免疫组化检查,并参照2013版《软组织与骨肿瘤WHO分类》中GCT的诊断标准,由病理科2名高年资主治医师以上职称、病理工作经验10年以上的医师共同复习切片后再次确认。
二、方法
采用回顾性描述性研究方法。收集整理9例患者的临床病理资料,包括患者的性别、年龄、肿瘤部位、大小、临床症状、检出方式、内镜表现、治疗方案、随访结果等信息,并分析其常规组织学形态和免疫表型特征等病理学资料。
常规组织病理学检查:9例患者组织经4%甲醛溶液固定,梯度乙醇脱水、石蜡包埋,4 μm厚连续切片,行HE染色,光学显微镜下观察。免疫组化法采用MaxVision两步法。所用一抗CKp、S100、CD68、CD56、Syn、SOX10、Desmin、SMA、 CD34、CD117、Dog1、Calretinin、α-inhibin和二抗以及显色试剂盒均购自福州迈新生物制剂有限公司。
一、病例资料
9例消化道GCT患者中,男性6例,女性3例;
年龄19~60岁,中位年龄52岁;
发生于食管6例,结直肠2例,肛管1例。3例食管GCT(病例1、2、4)因上腹部不适或上腹痛伴反酸、饱胀或烧心等症状行胃镜检查,1例患者(病例3)因胃癌根治术后复查内镜,均发现食管无蒂息肉;
2例患者(病例5、6)体检行内镜检查时发现食管黏膜下隆起,临床诊断食管息肉样隆起、食管平滑肌瘤、食管黄色瘤、GCT。2例结直肠GCT均因体检发现黏膜下隆起;
1例肛管GCT因肛门肿块脱出伴肛周痛而被发现,临床诊断外痔、肛瘘。2例食管GCT(病例1、2)行内镜下黏膜切除术(endoscopic mucosal resection, EMR);
余4例食管GCT和2例结直肠GCT均行内镜黏膜下剥离术(endoscopic submucosal dissection, ESD);
肛管GCT送检材料为局部切除标本。所有患者随访9~53个月,均未见肿瘤复发或转移(表1)。

表1 9例消化道GCT患者的临床病理情况
二、病理学检查
肿瘤直径2~12 mm,中位直径5 mm,切面呈灰白或灰黄色,实性、质地中等,与周围界限清楚。镜下肿瘤位于黏膜层和(或)黏膜下层,3例(病例1~3)位于黏膜层、6例(病例4~9)累及黏膜下层(表1、图1A、1B)。肿瘤呈实性片状、束状,外围呈浸润性生长,穿插黏膜肌层、延伸入黏膜固有层腺体之间或浸润黏膜下层。瘤细胞呈卵圆形、胖梭形或多边形,胞质丰富,内含大量嗜酸性颗粒,核小、卵圆形,核质比很低,核染色质细腻,核仁不明显,仅高倍镜下可见针尖大小的核仁(图1C、1D)。核分裂象未见/罕见。肿瘤间质富含薄壁毛细血管,可见炎性细胞如淋巴细胞、嗜酸性粒细胞和浆细胞浸润,甚或上述细胞形成聚集灶。免疫组化示瘤细胞均表达S100和CD68蛋白(图1E、1F),8例表达SOX10,6例表达CD56、Calretinin和Syn,Ki-67指数<2%;
CKp、Desmin、SMA、CD117、CD34、Dog1和α-inhibin均阴性(表2)。
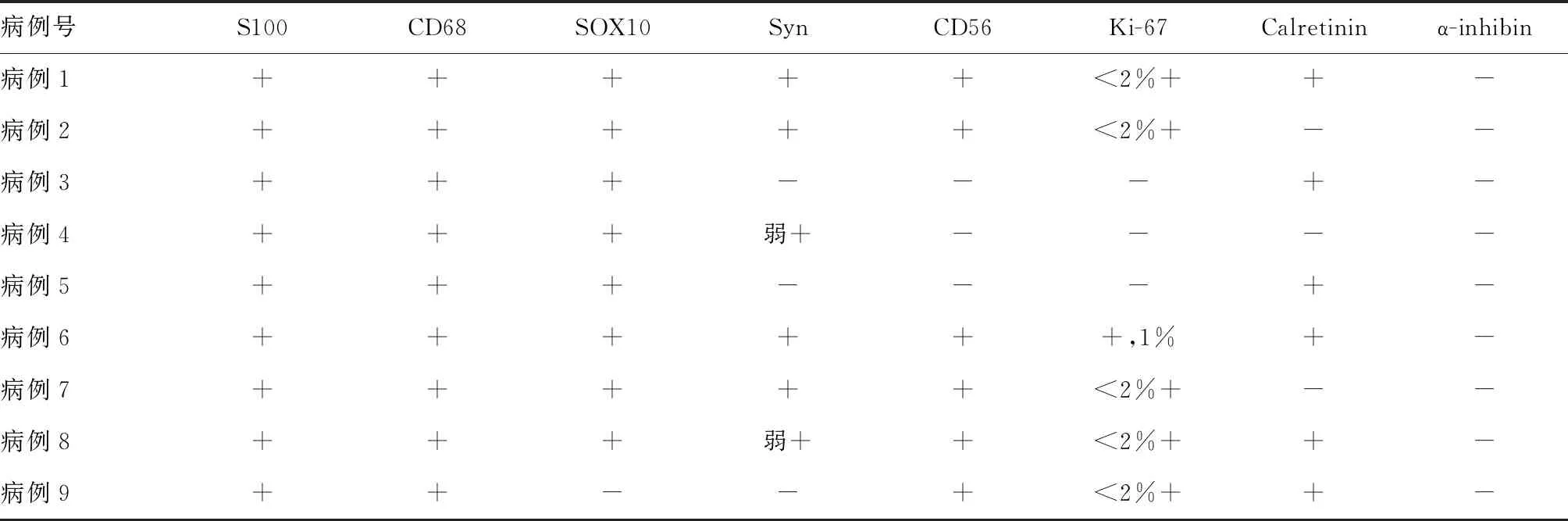
表2 9例消化道GCT患者的免疫组化结果

A:内镜检查示距门齿40 cm处食管后壁见一3 mm×4 mm的椭圆形隆起,凸向腔内;
B:与图A系同一病例,内镜超声示食管后壁见一3 mm×4 mm的椭圆形隆起,凸向腔内;
C:瘤组织呈实性片状,浸润黏膜固有层(HE染色,×100);
D:瘤细胞体积较大,胞质丰富,嗜酸性颗粒状,核小,核质比低,核仁不明显(HE染色,×200);
E:肿瘤细胞S100弥漫(+)(免疫组化染色,×100);
F:肿瘤细胞CD68(+)(免疫组化染色,×100)
一般而言,女性GCT更多见,但胃肠道GCT患者中男性略多;
消化道GCT任何年龄均可发病,40~60岁高发;
病变多为单发,6.2%的病例表现为多发,偶见伴发其他疾病[1]。随着消化内镜检查的普及,胃肠道GCT个案报道屡见不鲜,但大宗数据少见。An等[2]对98例胃肠道GCT患者进行总结分析,发现中位发病年龄为49岁,男女比例为2.2∶1,肿瘤好发于食管(75%),其次为结直肠(21%)和胃(4%);
中位肿瘤大小为3.7 mm,且食管GCT肿瘤大小明显小于结直肠和胃GCT(P<0.001)。本研究收集了9例胃肠道GCT,发病年龄为19~60岁,中位年龄为52岁;
男性多于女性;
好发于食管,与文献报道基本相符。
依据特征性组织病理学形态和免疫表型特点可明确诊断GCT。本研究中,GCT位于黏膜或黏膜下层,呈片状或巢状排列,瘤细胞肥胖,核质比极低,胞质丰富,含大量嗜酸性颗粒;
免疫组化恒定表达S100和CD68蛋白,不同比例表达SOX10、CD56、Syn和Calretinin,不表达CKp、Desmin、SMA、CD117、CD34、Dog1和α-inhibin。需排除或鉴别的疾病包括胃肠道常见的其他软组织肿瘤如平滑肌瘤、神经鞘瘤、胃肠间质瘤等,以及富含嗜酸性胞质的肿瘤如横纹肌瘤、嗜酸性腺瘤等。GCT分子病理学改变的研究少见。Wei等[3]对1例恶性GCT患者进行全基因组测序,发现其突变负荷率较低,存在肿瘤抑制因子BRD7基因的无义突变、酪氨酸激酶受体信号通路上的GFRA2基因突变,这些突变是否具有诊断意义还需进一步研究。
临床通常以有无转移作为判断良、恶性GCT的标准,同时考虑肿瘤大小、侵犯周围组织情况以及复发等因素。一组大宗数据meta分析显示2.42%的GCT病例出现远处转移[4],说明临床上恶性GCT较少见。病理学评估良、恶性GCT主要有两种方法,一种是Fanburg-Smith等[5]提出的依据6条形态学指标将GCT分为良性、不典型性和恶性,即核多形性、瘤细胞梭形、泡状核有大红核仁、核质比增高、坏死、核分裂象>2/10 HPF。不具备上述指标或仅局灶有核多形性者为良性;
具备1~2条者为不典型性;
具备3条或以上者为恶性。另一评估方法为近年Nasser等[6]提出的两级评估法,依据肿瘤有无坏死和(或)核分裂象分为良性和恶性潜能未定,该法简单且重复性好。Mobarki等[4]的研究系统性回顾了1 238例GCT病例,按Fanburg-Smith标准,良性、不典型性和恶性GCT比例分别为71.88%、16.77%和10.85%;
按Nasser两级评估标准,良性和恶性潜能未定比例分别为92.77%和7.23%,而临床上仅30例(2.42%)GCT出现转移。由此可见,临床诊断与病理学诊断结果并不完全相符,甚至少数病例病理学显示良性而临床上出现远处转移[7]。本组病例肿瘤均<2 cm、内镜超声示瘤组织限于黏膜层或黏膜下层,周围淋巴结未发现肿大;
术后病理检查未符合Fanburg-Smith或Nasser等提出的判断肿瘤为恶性或恶性潜能未定的任何标准,故本组病例临床和病理学诊断均为良性。
GCT的治疗首选肿瘤切除治疗。治疗前常规行内镜超声检查评估,如肿瘤限于黏膜层或累及黏膜下层但未广泛浸润黏膜下层、且肿瘤<2 cm,建议行EMR或ESD治疗[8-12]。EMR创面较表浅、术后出血穿孔概率低,适用于肿瘤较小(<1 cm)且限于黏膜层的病例;
ESD切除病变较EMR深且彻底,对累及黏膜下层的胃肠道GCT也适用。本组2例食管GCT病变小,均为0.2 cm,选择行EMR治疗;
6例累及黏膜肌层或黏膜下层的食管和结直肠GCT肿瘤大小为0.3~1.2 cm,行ESD治疗。所有患者随访9~53个月均无复发。如内镜超声下示病变广泛浸润黏膜下层或累及固有肌层或肿瘤>2 cm者,因EMR或ESD治疗伴发大出血和(或)穿孔的风险较大,建议行外科手术完整切除,术后常规随访监测复发情况。恶性GCT极少见,临床上常有肿瘤生长迅速、大小>4 cm、侵犯周围脏器、周围淋巴结肿大或远隔脏器转移等征象[13]。因病例积累少、缺乏随机对照试验数据,GCT尚未形成标准化治疗体系,目前普遍建议行肿瘤广泛切除术或肿瘤根治术[14-16]。对丧失手术治疗机会的病例,如放化疗效果欠佳也可考虑口服酪氨酸激酶抑制剂帕唑帕尼单抗进行治疗[17-19]。
良性GCT总体预后好,部分病例出现复发或恶性转化。复发与切缘是否阴性相关,如切缘阴性,肿瘤复发率为2%~8%;
如切缘阳性,肿瘤复发率约20%[4]。本组病例临床和术后病理均示良性GCT,其中1例(病例9)切缘阳性,密切随访14个月,无复发;
其余病例切缘均阴性,均无复发。恶性GCT五年生存率为62.8%,预后与肿瘤分期、是否行外科手术切除治疗以及性别等因素相关[20]。
总之,消化道GCT少见,临床上常无特异性症状,多在常规内镜检查中发现。内镜下多呈黏膜下隆起或无蒂息肉,内镜超声可评估病变性质和范围。确诊需行病理学检查,特征性形态学和免疫表型可进行诊断和鉴别诊断。病变小且浅表者行EMR或ESD治疗,效果好,但需长期随访。
猜你喜欢病理学消化道食管食管异物不可掉以轻心中老年保健(2021年9期)2021-08-24驴常见消化道疾病的特点及治疗现代畜牧科技(2021年6期)2021-07-16猪流行性腹泻病毒流行株感染小型猪的组织病理学观察上海农业学报(2017年4期)2017-04-1078例颅脑损伤死亡法医病理学分析中国卫生标准管理(2015年16期)2016-01-20Dieulafoy病变致消化道大出血的急救及护理天津护理(2015年4期)2015-11-10冠状动脉慢性完全闭塞病变的病理学和影像学研究进展医学研究杂志(2015年6期)2015-07-01胃结石伴食管嵌顿1例报道西南军医(2014年5期)2014-04-25中西医结合治疗胃食管反流病30例中国中医药现代远程教育(2014年23期)2014-03-01提高病理学教学效果的几点体会中国中医药现代远程教育(2014年13期)2014-03-01全胃切除术后消化道重建方式的研究进展西南军医(2014年1期)2014-02-03栏目最新:
- 2024年度在理论学习中心组关于群众路线...2024-01-16
- 在退役军人事务工作领导小组会议上讲话...2024-01-15
- 中秋国庆队伍教育管理工作动员部署会议...2024-01-15
- 2024年度区委书记在文旅农康融合发展大...2024-01-14
- 医院纪检监察干部队伍教育整顿个人党性...2024-01-14
- 教师演讲稿:牢记育人使命,涵养高尚师德...2024-01-13
- 2024年组织部长在市委理论学习中心组专...2024-01-13
- 2024年区人民法院案件质量评查办法(2篇...2024-01-13
- 2024年区长在指导某街道干部作风建设动...2024-01-11
- 在公司成立周年大会上讲话(3篇)(完整...2024-01-10
相关文章:
