昆虫神经肽tachykinin研究进展
刘晓光, 徐梦超, 王青鸽, 苏健诚, 魏纪珍, 安世恒
(小麦玉米作物学国家重点实验室, 河南省害虫绿色防控国际联合实验室, 河南农业大学植物保护学院, 郑州 450002)
昆虫体外信息交流和体内信号传递均离不开神经肽的参与[1-7]。神经肽是一类小分子活性多肽,主要由神经元(neurons)、神经内分泌细胞(neuroendocrine cells)或肠内分泌细胞(endocrine cells)分泌,其生成过程具有较高的相似性(图1),即神经肽基因经过转录、翻译后首先形成前体蛋白(precursor proteins,pro-proteins),前体蛋白在其N端具疏水结构的信号肽的引导下进入内质网(endoplasmic reticulum,ER)[8]。在内质网中,前体蛋白N端信号肽首先被切除,切除信号肽的其余肽段经历一系列翻译后修饰(糖基化、羟基化、N端酰基化和二硫键的形成)进入高尔基体,其序列中某些单个或者相邻两个位点氨基酸残基被特异性蛋白酶识别并切割(C端碱性残基由羧肽酶转化酶切除形成C端酰胺化或N端焦谷氨酰残基发生谷氨酰胺酰基环化)[9],最终形成具有生物活性的成熟多肽,这些活性多肽通过各种途径分泌到细胞外,最终达到靶位点,与G 蛋白偶联受体结合(G protein-coupled receptor, GPCR),激活下游信号通路[8,10]。随着基因组、转录组和多肽质谱等技术的快速发展,诸多神经肽得以发现。仅昆虫中就有30余种、数百个成熟肽得到鉴定[11-15]。其中tachykinin(TK)为众多神经肽中的一类,也称速激肽。TK 在进化上属于较为保守的脑-肠多肽(brain-gut peptide),参与生物的生长发育和生理行为活动[16-18]。TK含量虽少,但在昆虫生长发育过程中却起着异常重要的作用,对于以TK为代表的神经肽的深入研究,有助于人们更全面地了解昆虫生理功能及内分泌机制,为探索害虫治理提供科学依据。

图1 昆虫速激肽成熟肽合成释放过程
无脊椎动物中,TK最早发现于昆虫,Schoofs等收集并解剖9 000多头飞蝗Locustamigratoria脑-心侧体-咽侧体-咽下神经节复合体,通过分离纯化,首次获得TK的多肽序列[19-20]。利用类似方法,Muren等从1 000头马德拉蜚蠊Leucophaeamaderae的脑组织中成功分离纯化出7个TK多肽[21]。此后,研究者又陆续从黑腹果蝇Drosophilamelanogaster[22]、家蚕Bombyxmori[23]、赤拟谷盗Triboliumcastaneum[12]、豌豆蚜Acyrthosiphonpisum[24]、褐飞虱Nilaparvatalugens[25]、吸血蝽Rhodniusprolixus[26]、意大利蜜蜂Apismellifera[13]、二化螟Chilosuppressalis[14]、麦蛾茧蜂Habrobraconhebetor[15]和稻绿蝽Nezaraviridula[27]等其他昆虫中发现。
分类命名上,在脊椎动物中发现的速激肽称为典型的P物质(substance P,SP),主要包括神经激肽A(neurokinin A,NKA)和神经激肽B(neurokinin B, NKB)[28];在无脊椎动物包括昆虫中发现的称为TK或速激肽相关肽(tachykinin-related peptide, TKP),它们共同构成了速激肽超基因家族[29]。
目前研究结果表明,在编码昆虫TK蛋白的序列中一般含有多个TK成熟多肽,而单个成熟多肽通常由8~14个氨基酸残基组成,且C末端均发生酰胺化。如利用分离纯化方法,结合质谱技术研究者从飞蝗中鉴定出4种TK成熟肽[19-20],果蝇中有5种[30],家蚕和小地老虎Agrotisipsilon中有6种[23,31-32],意大利蜜蜂中鉴定出7种[13,33-34],赤拟谷盗中预测出8个[12],褐飞虱中预测出8个[25]。不同昆虫体内TK成熟肽数量不尽相同,但它们均由一个基因开放阅读框(open reading frame,ORF)编码的前体蛋白产生。大多数昆虫TK前体蛋白中,编码其成熟肽的氨基酸序列有一定的差异,但也有一些昆虫中存在一个前体蛋白所产生的若干个TK成熟肽氨基酸序列完全一致的现象(如意大利蜜蜂TK前体蛋白序列中有两个位点同时产生APMGFQGMR-amide成熟肽),不同昆虫产生的TK成熟肽也有个别序列完全一致,如马德拉蜚蠊与赤拟谷盗中均存在APSGFMGMR-amide成熟肽。这些多肽的鉴定和预测也为发现和研究相关受体提供了很好的基础。其次,除酰胺化外,这类成熟肽在 C端也相对保守,具有典型的FX1GX2R氨基酸基序(图2)。
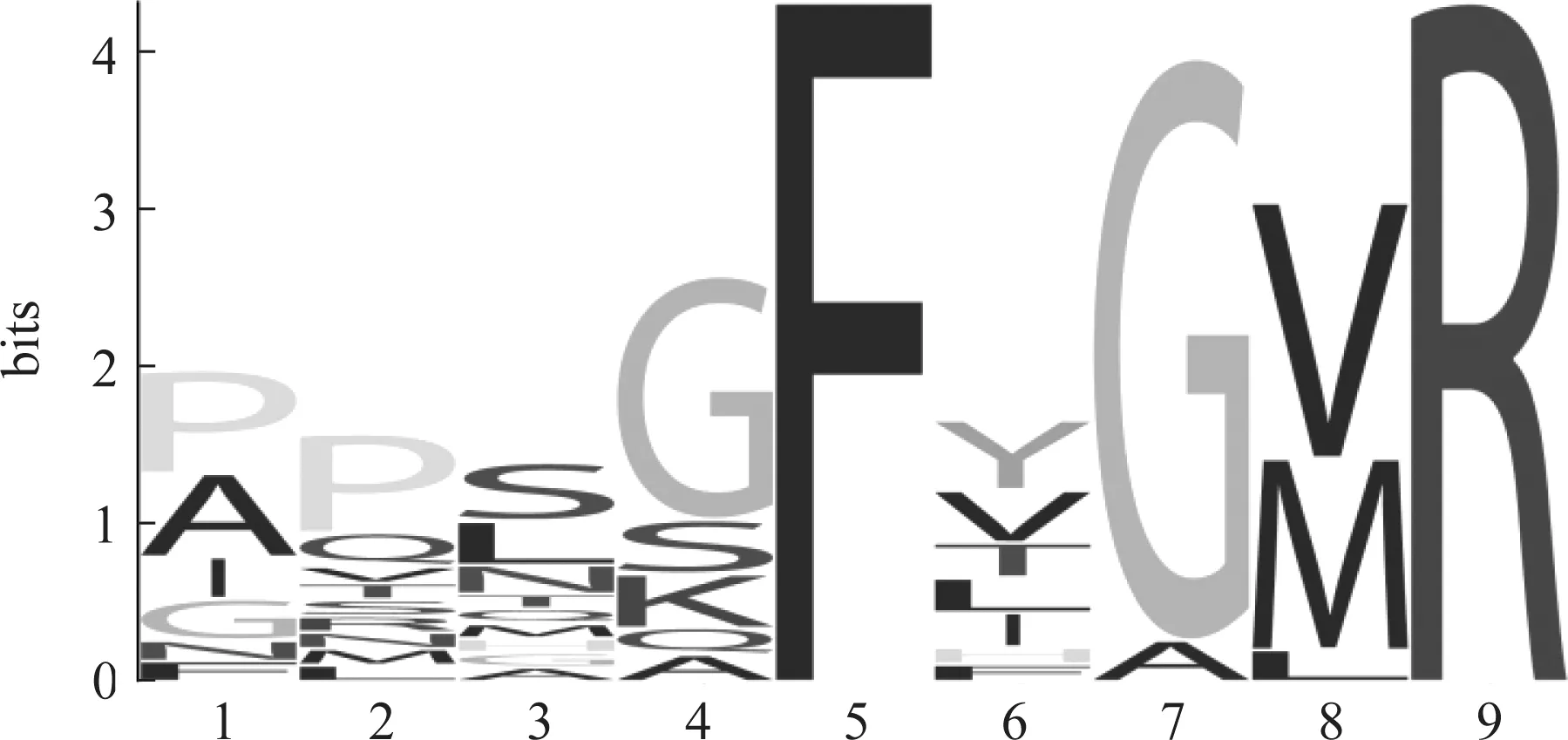
图2 昆虫速激肽成熟肽C端典型FX1GX2R基序
昆虫神经肽的分离与鉴定历经了较为漫长的发展过程。自Stone等从飞蝗和沙漠蝗Schistocercagregaria心侧体(corpus cardiacum)中分离并首次测序了神经肽脂动激素(adipokinetic hormone,AKH)开始[35],至Schoofs等成功分离并测定出TK部分序列,开启了有关昆虫TK研究的新征程,这也是在节肢动物中最早发现TK的正式报道,该传统研究方法沿用至今[19-20]。
在利用传统方法研究TK等神经肽过程中,样品前处理、活性组分的收集与分离等是获取活性神经肽的关键和难点。前处理过程需要两步,首先,组织解剖后样品需要尽快进行热变性或立即采用有机溶剂(如冰冻的色谱级甲醇)进行变性稳定处理,或液氮迅速冷冻后暂时存放于-80℃,防止成熟肽的快速降解[36];其次是样品除杂,样品组织需经超声破碎、离心后取上清液,上清液经超滤柱(膜)初步去除大分子蛋白。以上预处理样品再借助填充不同材料的色谱柱分离,根据单一峰或若干组合峰对应的液相分离液,准确收集并进一步将其冷冻浓缩获得活性组分。此步是获得活性神经肽的关键,技术上有一定的难度。因此,利用色谱柱分离是多肽分离技术的核心,其在实际应用中经历了较大改进与发展。该技术最初采用可控孔径玻璃珠(controlled-pore glass,CPG)作为吸附载体,先将小分子多肽过柱分离、浓缩,再经过硅胶薄层层析板(silica gel thin-layer plate)分离获得微量(μg)、纯度较高且具有活性的神经肽[35];随后又发展到利用高效液相色谱(highly performance liquid chromatography,HPLC)系统,与不同非极性反相(reversed-phase)色谱柱组合,充分利用色谱柱极性差异,不断更换色谱柱,依次反复纯化洗脱。洗脱粗组分经生物活性测定初步确定多肽分离的保留时间(每种多肽具有特殊的生理功能,可通过生物活性测定初步鉴定多肽种类)[37];进一步地,学者们又将免疫学与色谱技术结合,用神经肽(TK等)多克隆抗体结合放射免疫(radioimmunoassay,RIA)[2]或酶联免疫(enzyme-linked immunosorbent assay,ELISA)等技术[4]快速确定阳性组分,同时记录具有阳性组分所对应的更准确的保留时间,利用同样分离条件可在短时间内获得大量分离液,将收集到的分离液进一步冷冻浓缩,提高天然神经肽的获得率与产量,完善了TK神经肽等分离和鉴定技术[36]。由于该技术操作繁琐,对仪器及操作过程要求较高,目前国际上仅有少数实验室仍保留着以上传统的分离鉴定方法。此外,还可借助简单的反相色谱技术,前处理样品经过一次反相色谱分离得到粗产物,该粗产物在快速冷冻浓缩后无需经过其他色谱填料的反相色谱柱组合进行反复地分离,即可直接上质谱系统检测[32],还有将神经组织或脑组织切片直接上质谱获得TK精确分子量的报道[33-34]。此外,随着生物信息学和质谱技术的飞速发展,首先利用以上质谱技术,获得多肽的精确分子量,或者利用同位素标记相对和绝对定量(isobaric tags for relative and absolute quantification, iTraq)技术获得序列确定的多肽片段,再结合基因组、转录组,将收集到的组织样品与相应的质谱数据与氨基酸序列自动匹配,预测出神经肽成熟肽序列[32]。
昆虫TK与其他神经肽类似[1],最早从脑组织(脑-咽侧体-心侧体-咽下神经节)中分离[19-20],后来也在中肠发现,因此又称脑-肠肽[2]。有关TK的研究当数黑腹果蝇中最为详细,Veenstra等利用埃及伊蚊AedesaegyptiTK多肽制备的抗体,在黑腹果蝇成虫不同组织中进行了TK神经元定量分析,结果发现脑部最多,约700个,中肠中次之,约360个,其次是后肠,约140个,胸腹神经约110个,马氏管约10个,嗉囊最少,约4个[38]。类似地,有关TK神经元在烟草天蛾Manducasexta中的分布也有报道。在烟草天蛾成虫期,检测到TK神经元主要集中在中脑(midbrain),约有100个,其中视神经叶(optic lobe)中仅发现1个。而在5龄幼虫中,TK神经元主要集中在脑神经细胞,约有60个;其次是腹神经索(ventral nerve cord),其中咽下神经(suboesophageal ganglion)5对,胸神经(thoracic ganglia)2对,第5未融合的腹神经(fifth unfused abdominal ganglia)各1对,融合末端神经(fused terminal ganglion)3对,与黑腹果蝇成虫不同,在烟草天蛾成虫与幼虫的前肠和后肠中并未检测到TK神经元[39]。此外,借助新兴的单细胞转录组测序技术,Guo等首次研究了黑腹果蝇中肠肠内分泌细胞各类神经肽的分布特点,其中重点关注了TK神经元。结果表明,在中肠共富集并分离鉴定出10类肠内分泌神经元类群, 其中TK集中表达于4个主要细胞类群(即所分属的1、3、4和7肠内分泌细胞类群)。同时发现,TK成熟多肽具有与不同神经肽共表达的偏好性,即TK偏好在某些内分泌细胞中单独存在,或与DH31、CCAP、CCH、ITP、Gbp5、sNPF、NPF、Mip、Nplp2等单个或多个神经肽共表达,而极少或决不与神经肽AstC共表达[40]。
尽管昆虫TK不断被发现,但有关其受体的发掘和研究较少,目前已发现的潜在受体可归为3类。Li等利用哺乳动物同源TK受体(tachykinin receptor,TKR)基因作为探针,从黑腹果蝇cDNA文库中筛选并首次发现了第一类无脊椎动物TK受体,该受体由CG7887基因编码,也称为DTKR(Drosophilatachykinin receptor)或TKR99D[41]。第二类TK受体由CG6515基因编码,起初命名为果蝇神经激肽受体(neurokinin receptor fromDrosophila),简称NKD或TKR86C。这两类与哺乳动物神经激肽受体(mammalian neurokinin receptor)跨膜区序列有32%~48%的相似度[42]。第三类速激肽受体是从厩螯蝇Stomoxyscalcitrans中克隆获得,称为STKR,它与前两类受体在跨膜区相似度高达80%[43]。早期,由于试验方法和技术的限制,这些TK及其受体的研究一直是孤立的,无法建立联系,甚至受体基因的克隆早于TK的发现。直到2000年之后,遗传学家以果蝇为材料,利用转基因技术构建了大量基因缺失或过表达品系[22],才开始基因功能研究,但有关TK的研究在果蝇中尚未开展广泛研究,进展较为缓慢,其具体生理功能也尚不清楚。
配体/受体基因的获得为研究TK/TKR信号转导打开了一扇大门。目前,相关研究主要集中于基因组草图已经完成的模式昆虫。对于DTKR,Birse等利用不同体外细胞表达系统,在人肾源细胞HEK293和果蝇S2细胞系中均成功表达了DTKR,随后用人工合成的DTK1~DTK6等多肽分别处理以上两种细胞,结果均能在短时间内提升细胞内Ca2+浓度及环磷酸腺苷(cAMP)水平,并且,这些信号随多肽浓度的增大而显著上升[44]。而对于果蝇NKD,研究者分别利用中国仓鼠Cricetulusbarabensis卵巢细胞CHO-PAM28和果蝇S2细胞系表达了该受体。同样,分别加入人工合成的DTK1~DTK6、N端增加不同氨基酸残基而仍保留C端基序不变的DTK6和其他昆虫TK等神经肽刺激,结果除DTK6表现出较低的生物活性外,DTK1~DTK5等神经肽均无激活特性[45]。这些结果暗示了DTKR是DTK的潜在受体,而NKD则不是DTK的受体。在鳞翅目中也有类似研究,根据基因进化分析,发现家蚕TK受体BNGR-A24(Bombyxmorineuropeptide GPCR A24)与DTKR亲缘关系更近;而BNGR-A32和BNGR-A33与NKD具有较近的亲缘关系[46],这在一定程度上也表明TKR与NKD属两类不同的TK受体。此外,He等用2种不同细胞系即人胚胎肾细胞HEK293和草地贪夜蛾卵细胞系Sf21(Spodopterafrugiperdaovarian cell line 21)分别表达了BNGR-A24,随后用人工合成的家蚕TK检测生理活性,发现TK1~TK6(BmTK1~BmTK6)也分别能够快速提升细胞内Ca2+浓度及cAMP水平,cAMP水平随多肽浓度增加具有一定的浓度依赖性。这些结果也进一步表明了BNGR-A24是BmTK1~BmTK6潜在的受体[47]。
随后一个重要试验证明了果蝇、家蚕乃至其他一些模式昆虫的各种受体与各自配体的生物学关系。Jiang等在果蝇、家蚕和赤拟谷盗等模式昆虫中鉴定出一类C端相对保守、序列上类似TK的神经肽(C端为FxxxRa或YxxxRa motif),将其寓意为拉丁语 “出生”(natalisin,NTL)、并用拉丁化的NTL命名[48]。该团队随后进行了“受体/候选配体”体外细胞活性验证,结果显示果蝇DNTL1~DNTL5分别与受体NKD均有强烈的活性反应,相比而言,DTK6显现出的活性反应远低于DNTL1~DNTL5;而在家蚕中发现的12个NTL成熟多肽(BmNTL),其中BmNTL-1, BmNTL-3和 BmNTL-5(FxxxRa motif)可强烈激活BNGR-A33,而BmNTL-10和BmNTL-11(YxxxRa motif)强烈激活BNGR-A32;赤拟谷盗中发现的2个NTL对赤拟谷盗受体都具有生物活性反应[48]。自此,困扰了20多年有关TK与其受体的寻找终于“尘埃落定”,即DTKR(TkR99D)为DTK的受体,NKD(TkR86C)为果蝇NTL的受体;家蚕BNGR-A24为速激肽BmTK的受体,而BNGR-A32和BNGR-A33为BmNTL的受体;赤拟谷盗中也分别找到了TK和NTL及其相应受体。另外,在已知膜翅目昆虫意大利蜜蜂和丽蝇蛹集金小蜂Nasoniavitripennis基因组中,并没有发现NTL及其受体,而寄生于蜜蜂等膜翅目的常见螨虫则存在相应的NTL及其受体,可以将螨虫NTL及其受体作为靶标基因,这也为设计新的害虫靶标基因提供了很好的思路[48]。
有关昆虫TK/TKR信号转导机制和功能研究才刚刚开始,在这些工作中,浙江大学周耐明教授、堪萨斯州立大学Park和哈佛大学Song等领衔或所在的研究团队都做出了重要贡献[10,17,47-48]。他们分别在家蚕、赤拟谷盗和黑腹果蝇等模式昆虫中开展了相关研究,发现了一些重要的保守信号通路,即 TK与受体结合多数会引起cAMP、Ca2+等上升,可能通过PLC/Ca2+/PKC 或 AC/cAMP/PKA信号通路调控下游关键基因。同时,TK与受体结合后还可通过GRK5/PKC激酶途径实现受体自身磷酸化,通过招募β-arrestin2/Kurtz蛋白复合体,经网格蛋白包被小窝(clathrin-coated pits)快速将受体内吞,随后受体通过去磷酸化并最终恢复至细胞膜表面,形成完整信号转导过程[10](图3)。

图3 PKC,GRK5和β-arrestin2/BmKurtz参与TK/TKR信号通路中配体依赖的内吞过程
7.1 参与信息物质合成和感受
TK不仅具有促进成虫对信息化合物的感受,而且在性信息素合成、调控两性交配行为等方面具有重要功能。将转基因果蝇脑神经和咽下神经节中TK转录水平调低后,与对照品系相比,其对丁醇(butanol)、醋酸异戊酯(isoamyl acetate)和苯甲醛(benzaldehyde)等挥发性化合物的趋向选择性显著降低[7]。此外,研究还发现TK也参与昆虫对性信息素的感受。位于雄虫前足的味觉神经元受体Gr68a,能够通过味觉系统参与感知雄性同类射精管球(ejaculatory bulb)释放的抑性欲信息素成分CH503[(3R,11Z,19Z)-3-acetoxy-11,19-octacosadien-1-ol],该性信息素成分是雄性交配过程中留给雌性的信息物质,可以降低交配过的雌性对其他同种雄性的吸引力,从而避免该雌虫与其他雄虫发生重复交配。这一重要功能的实现,首先是通过配体即性信息素CH503与Gr68a受体结合后快速激活该信号通路,进一步通过肽能细胞(peptidergic cell)将该信号传导至雄性中央脑(central brain),而咽下区域(subesophageal zone,SEZ)正是作为感受信息、参与抑制其他雄虫与该雌虫重复交配行为的黑匣子。该黑匣子接收到上游转导信号后,其区域分布的8~10个能够分泌TK的特异性神经元并快速响应,释放TK成熟多肽,其中TK参与的一条信号可通过P1神经元簇(P1 neuron cluster),最终表现出抑制雄虫与该雌虫交配行为。利用RNAi将果蝇雄成虫的SEZ区域内TK转录水平定点下调,这些特定区域TK下调后的雄虫在与已交配过的雌虫接触后,其感知CH503能力显著降低,不能有效避免重复交配[49]。将人工合成的飞蝗TK(Lom-TK-Ⅲ和 Lom-TK-Ⅵ)[19],注射到家蚕体内或利用含有TK成熟肽的培养液离体培养雌蛾的性信息素腺体,结果发现,两种方式均可促进家蚕雌成虫性信息素的合成,而且随着TK剂量的增加,雌性性信息素合成量具有显著的浓度依赖性[50]。此外,研究还发现由TK祖先进化形成的另一分支神经肽natalisin,具有促进双翅目黑腹果蝇、橘小实蝇Bactroceradorsalis和鞘翅目赤拟谷盗交配的功能[18,48,51]。但因物种差异性,鳞翅目蛾类与鞘翅目或双翅目性信息素合成机制差异较大。目前研究已证明鞘翅目[51]和蜚蠊目性信息素合成由保幼激素(juvenile hormone,JH)调控[52-53],双翅目由蜕皮激素(20-hydroxyecdysone,20E)调控[54],而鳞翅目蛾类主要由性信息素合成激活肽(pheromone biosynthetic activating neuropeptide,PBAN)调控[55]。随着性信息素合成途径研究的深入,我们总结发现,自Fónagy首次报道TK参与性信息素合成之后[50], TK如何参与性信息素合成尚无新的报道,其作用机制也依然未知,而TK在参与家蚕等鳞翅目性信息素合成过程中扮演何种角色值得进一步探索。
7.2 参与取食及其他生理行为
昆虫在取食过程中,不仅受JH和20E这两大重要激素的影响,同时还受到诸多肽类激素的调节。研究表明,饥饿可诱导昆虫体内TK激素水平快速上升[56]。而增加TK量能够促进果蝇幼虫后肠收缩蠕动[57],减少体内脂肪含量[17],这可能与其促进心侧体内AKH的释放、增加cAMP的水平具有一定的相关性[6]。同时,TK还可减少体重增加量,显著缩短幼虫饥饿后搜寻食物时间[47],这一现象与其他肽类激素如胰岛素(insulin)和 sNPF(short neuropeptide F)类似[58]。进一步研究发现,果蝇脑和中肠部分胰岛素信号通路受到TK信号的严格调控,而且共同参与了维持体内海藻糖水平、抵御虫体饥饿和氧化应激反应[56,59]。此外,TK还参与了痛觉敏感信号通路(hedgehog signaling),该环路中TK所在的神经元发生突变后可以提升对热及紫外线的耐受性[60]。昆虫在整个生命阶段,时刻面临着各种环境压力,TK的分泌有助于昆虫提升抗逆能力。自然界中,昆虫取食各种寄主植物或其他食物的同时,从环境中获得大量有益环境微生物[61],取食后的食物在肠道微生物的参与下易于虫体吸收与利用, 更重要的是,某些有益微生物产生的短链脂肪酸乙酸盐可有效激活虫体先天免疫通路,进而通过促进TK大量分泌,在维持肠道脂肪稳态乃至机体健康方面发挥着重要作用[16]。
神经肽作为JH和20E之外的重要激素,在昆虫生长发育及生理行为方面同样发挥着重要的作用。研究发现,TK与其他30多类神经肽一样,均属于典型的脑-肠多肽。总结目前国内外已有的神经肽功能研究文献,发现其具有以下显著特征,有关脑部神经肽的试验侧重于行为功能研究,有关中肠组织内神经肽的试验则侧重代谢或免疫研究。因此,基于神经肽组织特异性和表达的时序性,对于昆虫TK的研究,已开始从传统的分离鉴定及基因克隆研究逐步转入基因功能与演化关系研究。一方面,可通过研究TK在不同类群昆虫中的共性特征,如参与脂质稳态[17]与饥饿下食物搜寻[56,59],了解昆虫的取食与能量代谢机制。另一方面,发掘TK在不同类群中的特有功能,如具有聚集习性的切叶蚁Acromyrmexechinatior工蚁(worker caste)体内TK基因转录水平要显著高于独居型的蚁后(queen),可能与膜翅目特殊的社会性、或其蛋白序列中TK成熟肽数量较多具有一定的相关性[13,62]。此外,对昆虫TK现有功能的研究和未知功能的挖掘,有助于探索昆虫在取食寄主植物及逃避或适应天敌寄生过程中适合度权衡具有重要生态学意义,可进一步深入地阐释TK在微生物-昆虫-植物三级营养关系层面所扮演的重要角色[61,63]。
猜你喜欢神经肽家蚕果蝇家蚕原原种“871”“872”种性变化分析四川蚕业(2022年2期)2022-11-19神经肽Y在心血管疾病中的研究进展医学综述(2022年5期)2022-04-20果蝇遇到危险时会心跳加速学苑创造·A版(2022年3期)2022-03-29棘皮动物神经肽结构与功能研究进展海洋科学(2021年6期)2021-08-022021年大樱桃园果蝇的发生与防控烟台果树(2021年2期)2021-07-21抗BmNPV家蚕新品种“川抗1号”的育成四川蚕业(2021年2期)2021-03-09家蚕猝倒病的发生与防治四川蚕业(2021年1期)2021-02-12小果蝇助力治疗孤独症学苑创造·A版(2019年6期)2019-07-11基于改进果蝇神经网络的短期风电功率预测测控技术(2018年7期)2018-12-09基于质谱技术的神经肽研究进展生物工程学报(2017年7期)2017-08-01栏目最新:
- 2024年度在理论学习中心组关于群众路线...2024-01-16
- 在退役军人事务工作领导小组会议上讲话...2024-01-15
- 中秋国庆队伍教育管理工作动员部署会议...2024-01-15
- 2024年度区委书记在文旅农康融合发展大...2024-01-14
- 医院纪检监察干部队伍教育整顿个人党性...2024-01-14
- 教师演讲稿:牢记育人使命,涵养高尚师德...2024-01-13
- 2024年组织部长在市委理论学习中心组专...2024-01-13
- 2024年区人民法院案件质量评查办法(2篇...2024-01-13
- 2024年区长在指导某街道干部作风建设动...2024-01-11
- 在公司成立周年大会上讲话(3篇)(完整...2024-01-10
相关文章:
