LncRNA,Neat1调控miR-128-3p表达对创伤性脑损伤小鼠认知功能和神经炎症的影响
余秋男 刘京让 宋海龙
创伤性脑损伤(TBI)是全球死亡率和发病率的主要原因,该疾病造成的全球经济损失约为4 000亿美元,占世界生产总值的0.5%[1]。目前对于原发性头部创伤的有效治疗方案较多,但治疗继发性损伤的治疗方案主要是降低炎性反应、阻止急性期神经元死亡、减少氧化应激损伤以及抗神经兴奋性毒性[2]。长链非编码RNA(LncRNA)最初被认为是转录的副产品,但越来越多的证据表明lncRNA在调节许多生物学过程中发挥着关键作用。核富集转录本1(Neat1)作为LncRNA家族中的一员,在TBI发生后具有显著变化[3]。微小RNA(miRNA)可参与许多疾病的病理生理过程,且脑特异性miRNA的检测可作为TBI的替代标志物。研究表明miR-128-3p有望作为TBI血液中的生物标志物[4]。生物信息学预测到Neat1与miR-128-3p存在结合位点。本实验通过自由落体法建立TBI小鼠模型,探讨LncRNANeat1靶向调节miR-128-3p表达对TBI小鼠认知功能和神经炎症的影响。
1.1 材料
1.1.1 实验动物:清华大学提供雄性、BALB/c小鼠80只,要求:8周龄,体重25~28 g,许可证号:SCXK(京)2019-0016。小鼠饲养温度、湿度分别为:22℃~25℃、55%~65%,定时通风、消毒。本研究经动物伦理委员会批准。
1.1.2 试剂与仪器:武汉普诺赛生命科技有限公司提供293T细胞(产品编号:CL-0005);由上海生工生物有限公司构建野生型和突变型Neat1荧光素酶报告基因载体(Neat1 WT、Neat1 MUT);由上海生工生物工程有限公司合成腺病毒空载体组(Ad-NC)、Neat1过表达腺病毒(Ad-Neat1)、miR-128-3p模拟物阴性对照(immics NC)、miR-128-3p抑制物阴性对照(inhibitor NC)、miR-128-3p模拟物(miR-128-3p mimic)、miR-128-3p抑制物(miR-128-3p inhibitor)以及Neat1、miR-128-3p、U6、β-actin引物;上海恪敏生物科技有限公司提供白细胞介素-6(IL-6,货号:BH8273)、肿瘤坏死因子-α(TNF-α)ELISA试剂盒(货号:E-EL-M0049);abcam公司提供半胱天冬氨酸蛋白酶-1(Caspase-1,caspase-1,货号:ab179515)、核因子-κB p65(NF-κB p65,货号:ab207297)、磷酸化核因子-κB p65(Phospho-Nuclear factor-κB p65,p-NF-κB p65;货号:ab76302)一抗。上海豫光仪器有限公司提供荧光显微镜;美谷分子仪器有限公司全功能酶标仪。
1.2 方法
1.2.1 TBI小鼠模型的制备[5]:将小鼠随机分为造模组(70只)和假手术组(10只),戊巴比妥麻醉小鼠,对其头皮进行消毒,沿小鼠头顶正中央切开,于右侧顶叶进行开窗手术,之后固定小鼠;在颅骨上方15 cm处自由降落小锤(质量约为20 g),缝合头皮。创伤后取出脑组织,观察小鼠有创伤灶出现,且伴随出血、伤灶周围脑组织挫伤等现象时,表明造模成功。假手术组小鼠仅开窗、缝合,但不敲击。
1.2.2 qRT-PCR检测血清中Neat1、miR-128-3p表达水平:选取各组小鼠,静脉取血,提取总RNA,逆转录为cDNA。以cDNA为模板进行qRT-PCR反应,反应体系、条件参照qRT-PCR试剂盒说明书。分别以U6、GAPDH为内参,采用2-ΔΔCt计算Neat1、miR-128-3p相对表达水平。见表1。

表1 qRT-PCR引物序列
1.2.3 TBI小鼠分组及干预:将70只造模组小鼠随机分为模型组、Ad-NC组、Ad-Neat1组、inhibitor NC组、miR-128-3p inhibitor组、Ad-Neat1+miR-128-3p mimic组、Ad-Neat1+mimic NC组,10只/组,另取10只假手术组小鼠。将小鼠经戊巴比妥钠麻醉后,对头部消毒,于正中切开皮肤、分离骨膜。固定头部于脑立体定位仪中,将Ad-Neat1组、Ad-NC组小鼠分别于侧脑室注射4.5 μl重组腺病毒、空载体腺病毒,注射速度为0.2 μl/min、病毒滴度为4×1010PFU/ml[6];inhibitor NC组、miR-128-3p inhibitor组分别注射40 mg/kginhibitor NC、miR-128-3p inhibitor[7];Ad-Neat1+miR-128-3p mimic组、Ad-Neat1+mimic NC组分别先注射4.5 μl重组腺病毒,再分别注射40 mg/kg miR-128-3p mimic、inhibitor NC;假手术组、模型组小鼠注射等体积的0.9%氯化钠溶液,1次/d,连续1周。
1.2.4 测定小鼠认知功能:干预完成后,对8组小鼠进行Morris水迷宫实验,测定逃避潜伏期、穿越原平台位置的次数,作为小鼠认知功能的评价标准[8]。
1.2.5 ELISA检测小鼠血清中炎性因子水平:水迷宫实验实验结束后,麻醉小鼠,静脉取血,离心取上清,按照ELISA试剂盒步骤进行检测。
1.2.6 HE染色观察小鼠伤灶周围脑组织病变状况:取适量小鼠伤灶周围脑组织,制作切片,行HE染色,脱水,封片,于显微镜下观察病理变化。
1.2.7 双荧光素酶检验Neat1、miR-128-3p关系:生物信息学方法预测到Neat1、miR-128-3p存在结合位点。常规培养293T细胞并分为miR-128-3p mimic+Neat1 WT组、mimic-NC+Neat1 WT组、miR-128-3p mimic+Neat1 MUT组和mimic-NC+Neat1 MUT组,分别将miR-128-3p mimic与突变型、野生型Neat1 3’UTR,mimic-NC与突变型、野生型Neat1 3’UTR,转染48 h后测定荧光素酶活性。
1.2.8 Western blot检测伤灶周围脑组织中caspase-1、p-NF-κB p65/NF-κB p65表达:取适量小鼠伤灶周围脑组织,加入裂解液,测定蛋白总浓度,分离,转膜、封闭。加入caspase-1、NF-κB p65、p-NF-κB p65一抗于4℃孵育过夜,洗膜后,加入二抗室温孵育2 h,显影,曝光,β-actin为内参,分析8组蛋白表达水平。

2.1 小鼠血清中Neat1、miR-128-3p表达水平 模型组Neat1表达较假手术组显著降低(P<0.05),而miR-128-3p表达水平显著增加(P<0.05)。见表2。
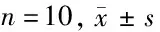
表2 小鼠血清中Neat1、miR-128-3p表达水平比较
2.2 8组小鼠伤灶周围脑组织病理学变化 假手术组小鼠脑组织无病理损伤;模型组、Ad-NC组、inhibitor NC组小鼠伤灶周围脑组织均出现大量炎性浸润、细胞坏死现象;与Ad-NC组比较,Ad-Neat1组炎性浸润、细胞坏死明显降较少;与inhibitor NC组比较,miR-128-3p inhibitor组病理现象均得到改善;与Ad-Neat1+mimic NC组比较,Ad-Neat1+miR-128-3p mimic组炎性浸润、细胞坏死现象加重。见图1。

假手术组 模型组 Ad-NC组 Ad-Neat1组
2.3 预测与验证Neat1、miR-128-3p的靶向关系 生物信息学预测Neat1、miR-128-3p存在结合位点。Neat1 WT+mimic NC组比较,Neat1 WT+miR-128-3p mimic组荧光素酶活性显著降低(P<0.05);Neat1 WT+miR-128-3p mimic组、Neat1 MUT+mimic NC组、Neat1 MUT+miR-128-3p mimic组荧光素酶活性无明显变化(P<0.05)。见图2,表3。

图2 生物信息网预测Neat1、miR-128-3p结合位点;WT:wild-type,野生型;MUT:mutant-type,突变型

表3 荧光素酶检测Neat1、miR-128-3p的靶向关系
2.4 Neat1过表达对TBI小鼠血清炎性因子、认知功能及Neat1表达的影响 模型组、Ad-NC组IL-6、TNF-α含量、平均逃避潜伏期较假手术组显著增加(P<0.05),而Neat1表达、穿越平台次数显著降低(P<0.05);Ad-Neat1组IL-6、TNF-α含量、平均逃避潜伏期较Ad-NC组显著降低(P<0.05),而Neat1表达、穿越平台次数显著增加(P<0.05)。见表4。
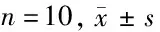
表4 过表达Neat1对TBI小鼠中Neat1表达、炎性因子、认知功能的影响
2.5 沉默miR-128-3p对TBI小鼠血清炎性因子、认知功能及Neat1表达影响 模型组、inhibitor NC组IL-6、TNF-α含量、miR-128-3p表达、平均逃避潜伏期较假手术组显著增加(P<0.05),而穿越平台次数显著降低(P<0.05);miR-128-3p inhibitor组IL-6、TNF-α含量、miR-128-3p表达、平均逃避潜伏期较inhibitor NC组显著降低(P<0.05),而穿越平台次数显著增加(P<0.05)。见表5。
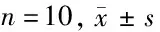
表5 过表达Neat1对TBI小鼠中Neat1表达、炎性因子、认知功能的影响
2.6 Neat1过表达或沉默miR-128-3p对伤灶周围脑组织中caspase-1、p-NF-κB p65/NF-κB p65表达的影响 模型组、inhibitor NC组caspase-1、p-NF-κB p65/NF-κB p65表达较假手术组显著增加(P<0.05);miR-128-3p inhibitor组caspase-1、p-NF-κB p65/NF-κB p65表达较inhibitor NC组显著降低(P<0.05);模型组、Ad-NC组caspase-1、p-NF-κB p65/NF-κB p65表达较假手术组显著增加(P<0.05);Ad-Neat1组caspase-1、p-NF-κB p65/NF-κB p65表达较Ad-NC组显著降低(P<0.05)。见图3,表6。

图3 8组小鼠caspase-1、NF-κB p65蛋白表达Western blot图;A为假手术组;B为模型组;C为Ad-NC组;D为Ad-Neat1组;E为inhibitor NC组;F为miR-128-3p inhibitor组;G为Ad-Neat1+mimic NC组;H为Ad-Neat1+miR-128-3p mimic组
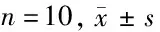
表6 Neat1过表达或沉默miR-128-3p对伤灶周围脑组织中caspase-1、p-NF-κB p65/NF-κB p65表达的影响
2.7 过表达Neat1和miR-128-3p对TBI小鼠炎性因子、认知功能及caspase-1、p-NF-κB p65/NF-κB p65表达的影响 Ad-Neat1+miR-128-3p mimic组IL-6、TNF-α含量、平均逃避潜伏期、caspase-1、p-NF-κB p65/NF-κB p65表达较Ad-Neat1+mimic NC组显著增加(P<0.05),而穿越平台次数显著降低(P<0.05),但各项指标与Ad-Neat1组差异无统计学意义(P>0.05)。见表7。
表7 过表达Neat1和miR-128-3p对TBI小鼠中炎性因子、认知功能的影响
TBI可定义为外力引起的脑功能紊乱等一系列脑病理疾病,属于常见的神经系统损伤疾病。据报道全球每年有250多万人受其影响[9]。该疾病的发病率、致残率及致死率均较高,严重影响患者及家庭的生活[10]。因此本实验通过自由落体方法复制TBI小鼠模型,当小鼠有创伤灶出现,且伴随出血、伤灶周围脑组织挫伤等现象时,表明造模成功,可进行关注该病的探索。
lncRNA是一类长度>200个核苷酸的RNA,在人体组织中广泛表达。研究表明,lncRNA 在中枢神经系统中高度表达,影响大脑发育和功能[11]。Chai等[12]研究发现,Neat1上调可以通过抑制PIDD1-caspase-2通路,减少caspase-1的活化,减少细胞色素C的释放,改善脑外伤后继发性脑损伤。Zhong等[13]研究发现贝沙罗汀上调lncRNA Neat1,抑制炎性反应,从而使TBI小鼠的运动和认知功能得到改善。本实验结果表明模型组Neat1表达较假手术组显著降低,表明Neat1下调与TBI关系密切,Ad-Neat1组IL-6、TNF-α含量、平均逃避潜伏期较Ad-NC组显著降低,而Neat1表达、穿越平台次数显著增加。表明过表达Neat1可以减轻炎性浸润,改善小鼠认知功能。
mRNAs转录后参与各种病理生理过程,包括脑损伤的发生。O’Connell等[4]研究发现TBI患者的血清中miR-128-3p水平显著上升,在急性期护理中可作为TBI的生物标志物。本实验研究发现TBI小鼠中miR-128-3p水平显著上升miR-128-3p inhibitor组IL-6、TNF-α含量、miR-128-3p表达、平均逃避潜伏期较inhibitor NC组显著降低,而穿越平台次数显著增加。表明抑制miR-128-3p表达可以改善小鼠认知功能,降低炎性反应。
生物信息学预测Neat1与miR-128-3p存在结合位点。Chen等[14]研究报道了NEAT1/miR-128-3p/ITGA5轴参与了胶质瘤的发生和进展,并可能为治疗胶质瘤提供一种新的潜在策略。Xian等[15]研究表明NEAT1通过靶向调节miR-128-3p,可降低炎性反应,缓解脊髓损伤诱导的神经性疼痛。另外,Caspase1在细胞凋亡过程中可导致炎性因子的大量释放,而细胞凋亡又与TBI密切相关[16]。NF-κB信号通路广泛参与TBI的发生发展过程,抑制NF-κB信号通路可减轻炎性因子的释放以发挥神经抗炎作用[17]。本实验经荧光素酶实验验证miR-128-3p为Neat1靶向作用点,且研究发现Ad-Neat1+miR-128-3p mimic组IL-6、TNF-α含量、caspase-1、p-NF-κB p65/NF-κB p65、平均逃避潜伏期较Ad-Neat1+mimic NC组显著增加,而穿越平台次数显著降低。表明miR-128-3p mimic可通过调控Caspase1、NF-κB表达逆转LncRNA Neat1发挥的作用。
综上所述,LncRNA Neat1过表达可以靶向抑制miR-128-3p表达,抑制炎性反应,改善TBI小鼠认知功能,为TBI的研究提供新思路,但由于作用机制复杂,还需再探索。
猜你喜欢荧光素酶脑组织靶向如何判断靶向治疗耐药保健医苑(2022年5期)2022-06-10NNMT基因启动子双荧光素酶报告系统的构建及其与SND1靶向关系的验证天津医科大学学报(2021年4期)2021-08-21MUC1靶向性载紫杉醇超声造影剂的制备及体外靶向实验中国临床医学影像杂志(2021年6期)2021-08-14不同双荧光素酶方法对检测胃癌相关miRNAs靶向基因TIAM1的影响中日友好医院学报(2021年1期)2021-04-14毛必静:靶向治疗,你了解多少?肝博士(2020年5期)2021-01-18重组双荧光素酶报告基因质粒psiCHECK-2-Intron构建转染及转染细胞萤火虫荧光素酶和海肾荧光素酶表达山东医药(2020年9期)2020-05-20小脑组织压片快速制作在组织学实验教学中的应用中国组织化学与细胞化学杂志(2017年1期)2017-06-15芒果苷对自发性高血压大鼠脑组织炎症损伤的保护作用中成药(2017年6期)2017-06-13DNA双加氧酶TET2在老年痴呆动物模型脑组织中的表达及其对氧化应激中神经元的保护作用吉林大学学报(医学版)(2015年4期)2015-12-17靶向超声造影剂在冠心病中的应用医学研究杂志(2015年7期)2015-06-22栏目最新:
- 2024年度在理论学习中心组关于群众路线...2024-01-16
- 在退役军人事务工作领导小组会议上讲话...2024-01-15
- 中秋国庆队伍教育管理工作动员部署会议...2024-01-15
- 2024年度区委书记在文旅农康融合发展大...2024-01-14
- 医院纪检监察干部队伍教育整顿个人党性...2024-01-14
- 教师演讲稿:牢记育人使命,涵养高尚师德...2024-01-13
- 2024年组织部长在市委理论学习中心组专...2024-01-13
- 2024年区人民法院案件质量评查办法(2篇...2024-01-13
- 2024年区长在指导某街道干部作风建设动...2024-01-11
- 在公司成立周年大会上讲话(3篇)(完整...2024-01-10
相关文章:
